Reanimación cardiopulmonar en circunstancias especiales, según las nuevas guías del 2025 de la comité europeo de reanimación. Publicado en https://www.resuscitationjournal.com/article/S0300-9572(25)00265-5/fulltext. https://doi.org/10.1016/j.resuscitation.2025.110753
Dr. Andrés Cairol, editor revista, revisión y traducción.
Introducción
El paro cardíaco, independientemente de su etiología, requiere una intervención inmediata, que implica un reconocimiento rápido, una solicitud de asistencia de emergencia y una reanimación cardiopulmonar (RCP) de alta calidad, con interrupciones mínimas. El manejo efectivo implica la rápida identificación y el tratamiento de causas reversibles, a menudo resumidas en el mnemónico «4Hs y 4T». Sin embargo, los protocolos estándar de soporte vital no son universalmente aplicables, ya que las circunstancias especiales necesitan modificaciones a estas directrices. El ERC clasifica estas circunstancias especiales en tres partes:
1.Causas especiales que conducen a intervenciones específicas.
2.Entornos especiales donde los factores o etiologías únicas del sitio requieren enfoques personalizados.
3.Poblaciones especiales de pacientes, caracterizadas por condiciones preexistentes o comorbilidades que requieren diferentes estrategias de tratamiento modificadas.Estas Directrices del ERC 2025 sobre Circunstancias Especiales en la Reanimación se basan en el Consenso anual de 2025 sobre la Ciencia con Recomendaciones de Tratamiento (CoSTR) del Comité de Enlace Internacional sobre Reanimación (ILCOR).1 Muchos temas abordados en estas Directrices de Circunstancias Especiales no formaron parte de la revisión de ILCOR. Por lo tanto, varias recomendaciones se basan en el consenso de las Directrices del ERC 2025 Circunstancias Especiales en el grupo de redacción de Reanimación basadas en revisiones sistemáticas o de alcance adicionales o artículos originales seleccionados Tabla 1. La metodología más amplia utilizada para el desarrollo de directrices se presenta en el Resumen Ejecutivo.2 Estas Directrices se publicaron para comentarios públicos entre el 15 de mayo y el 30 de mayo de 2025. Un total de 54 personas enviaron 66 comentarios, lo que llevó a 9 cambios en la versión final. Posteriormente, los comentarios fueron revisados por el grupo de redacción, y las Directrices se actualizaron posteriormente cuando fuera relevante. Las Directrices fueron presentadas y aprobadas por la Junta del ERC y la Asamblea General del ERC en junio de 2025.
A los efectos de estas Directrices, el término RCP se relaciona con las habilidades técnicas específicas de la reanimación cardiopulmonar (por ejemplo, métricas de rendimiento de compresión torácica y ventilación), mientras que la reanimación se utiliza como un término genérico que cubre la gama más amplia de habilidades e intervenciones. El término espectador se utiliza para describir a los rescatistas que están en la escena para brindar ayuda, y el término socorrista se utiliza para aquellos que tienen capacitación adicional y son alertados para asistir a la escena de un paro cardíaco. Los profesionales de la salud (HCP) se definen como aquellos que trabajan en cualquier sector de la salud (prehospitalario o en el hospital). Los laicos son personas que no trabajan en el sector de la salud. El soporte vital básico (BLS) se define como el inicio de la cadena de supervivencia, la compresión torácica temprana de alta calidad, la ventilación efectiva y el uso temprano de un DEA. Cualquier forma de educación de reanimación más allá del BLS se describe genéricamente como soporte vital avanzado (soporte vital neonatal, pediátrico y adulto). Cuando se utiliza el término «ALS», se refiere específicamente al curso de soporte vital avanzado para adultos del ERC.
El grupo de redacción de estas Directrices del ERC 2025 sobre Circunstancias Especiales en la Reanimación consideró el enfoque recientemente introducido del ERC sobre la diversidad, la igualdad, la equidad y la inclusión y lo aplicó siempre que fue posible, reconociendo que este es un campo para mejorar en el desarrollo de directrices basadas en la evidencia. El ERC tiene como objetivo avanzar en las prácticas de reanimación y mejorar la atención al paciente a escala global (ver Fig. 1). La Tabla 1 muestra los cambios en las Circunstancias Especiales de las Directrices de Reanimación del ERC de 2021 a 2025.

Directrices concisas para la práctica clínica
Recomendaciones generales
•Inicie la reanimación siguiendo el algoritmo estándar de ELA en el paro cardíaco.•Siempre aborde la hipoxia, la hipovolemia, los trastornos electrolíticos, la hipotermia, el taponamiento cardíaco, el neumotórax por tensión, la trombosis y los agentes tóxicos.•Cuando sea apropiado, priorice el tratamiento de causas reversibles, incluso si las compresiones torácicas se interrumpen brevemente.
Causas especiales
Manejo y prevención del paro cardíaco debido a la anafilaxia
•El reconocimiento rápido de la anafilaxia es crucial.•Reconocer la anafilaxia por la presencia de problemas de las vías respiratorias, respiratorios o de circulación con o sin cambios en la piel y la mucosa.•Retire o detenga el gatillo si es inmediatamente posible.•Inyécte inmediatamente 0,5 mg de adrenalina intramuscular a la primera sospecha de anafilaxia y repita si no hay mejoría dentro de los 5 minutos.•Dé un bolo de fluido cristaloide IV temprano y controle la respuesta.
Hiper/hipopotasemia y otros trastornos electrolíticos
Hiperpotasemia (Fig. 2)
•Desplazar el potasio a las célulasODar 10 unidades de insulina soluble y 25 g de glucosa IV para el tratamiento de la hiperpotasemia moderada y grave. Siga con una infusión de glucosa al 10 % a 50 ml/h durante 5 h si la glucosa en sangre previa al tratamiento es < 7 mmol/l.OAdministrar salbutamol nebulizado (10-20 mg) para la hiperpotasemia moderada y grave, como complemento de la terapia con insulina-glucosa.
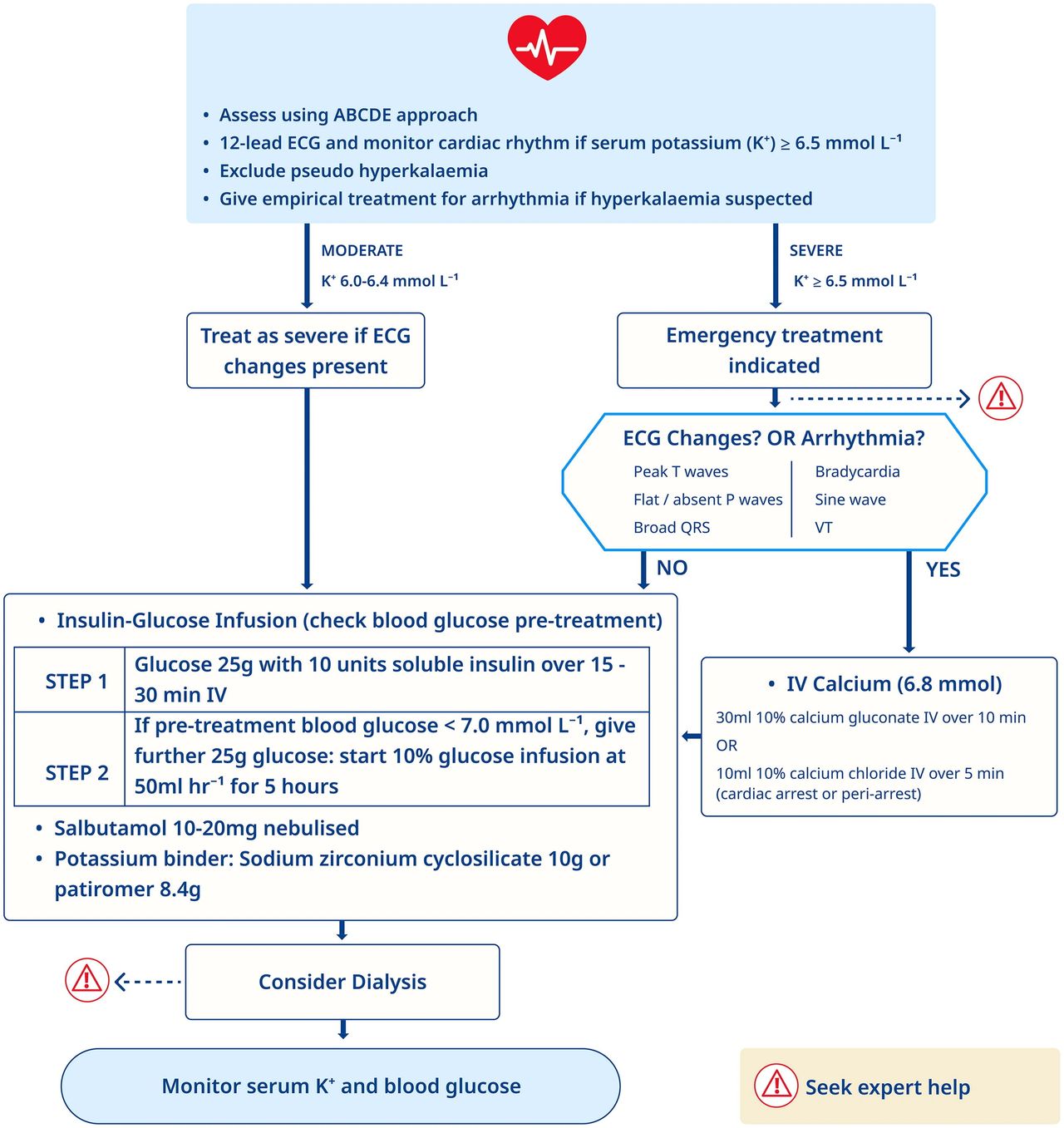
Antagoniza el efecto de la hiperpotasemiaO
Use IV 10 ml de cloruro de calcio al 10 % para pacientes con hiperpotasemia grave con cambios en el ECG.
O
Administrar IV 10 ml de cloruro de calcio al 10 % y 50 mmol de bicarbonato de sodio, a través de líneas separadas o con un lavado entre ellas, en el tratamiento del paro cardíaco hipercalémico en todos los entornos de hiperpotasemia grave.
•
Eliminar el potasio del cuerpoO
Dar ciclosilicato de circonio sódico 10 g por vía oral.
O
Considere la diálisis para pacientes con hiperpotasemia grave refractaria.
•
Considere la ECPR de acuerdo con los protocolos locales si el intento inicial de reanimación no tiene éxito.
Paso 1: Infusión de insulina-glucosa (comprobar el tratamiento previo a la glucosa en sangre)Glucosa 25 g con 10 unidades de insulina soluble en 15 -30 minutos IV
Si la glucosa en sangre previa al tratamiento es <7,0 mmol L, administre 25 g adicionales de glucosa: comience la infusión de glucosa al 10%
PASO 2 50 ml hr durante 5 horas• Salbutamol 10-20 mg nebulizado
• Aglutinante de potasio: ciclosilicato de circonio de sodio 10 g o patirómero 8,4 g
Hipopotasemia
•El tratamiento se guía por la gravedad de la hipopotasemia y la presencia de síntomas y/o anomalías del ECG.•Cuando corresponda, reemplace el potasio y corrija el déficit de magnesio simultáneamente.•Dar 20 mmol de cloruro de potasio por vía intravenosa durante 2-3 minutos, seguido de 10 mmol durante 2 minutos en paro cardíaco hipocalémico, luego controle el nivel de K+ y ajuste la tasa de infusión en consecuencia.
Hipertermia, hipertermia maligna e hipertermia inducida por toxinas
Hipertermia
•Mida la temperatura central para guiar el tratamiento.•Mueva al paciente a un ambiente fresco.•El simple enfriamiento externo puede implicar medidas conductoras, convectivas y por evaporación (ver Directrices de primeros auxilios del ERC 2025).3•Con el síncope de calor y el agotamiento del calor, la eliminación rápida a un lugar fresco, la simple refrigeración externa y el suministro de fluidos son suficientes•Con el golpe de calor, priorice los métodos de enfriamiento activo que logren la velocidad de enfriamiento más rápida, como la aplicación de hielo y la inmersión en agua fría (Fig. 3).
Hipertermia maligna
•Deje de activar agentes inmediatamente. Esto incluye apagar y quitar el vaporizador y cambiar el circuito del ventilador.•Dar intravenoso 2,5 mg/kg de dantroleno lo antes posible.•Iniciar el enfriamiento activo.•Dar 100 % de oxígeno y apuntar a la normocapnia usando hiperventilación.•Cambia el ventilador. Si no se puede cambiar el ventilador, cambie los filtros de carbón•Póngase en contacto con un centro de hipertermia maligna para obtener asesoramiento y seguimiento.
Hipertermia inducida por toxinas
•Minimizar la exposición y absorción de la toxina.•Utilice técnicas de enfriamiento activo. Los antipiréticos no tienen ningún beneficio, ya que los mecanismos termorreguladores centrales se ven afectados por las toxinas.
Hipotermia accidental y rescate de avalanchas
Mida la temperatura central con un termómetro de baja lectura para diagnosticar la hipotermia accidental.•Utilice el sistema de ensayo suizo si no se puede medir la temperatura central.•Transfiera a los pacientes hipotérmicos con factores de riesgo de paro cardíaco inminente y a aquellos en paro cardíaco directamente a un centro de soporte vital extracorpóreo (ECPR) para que se recalenten.•Retrasar la RCP o usar la RCP intermitente en pacientes con paro cardíaco hipotérmico con una temperatura central inferior a 28 °C cuando la RCP inmediata o continua no es factible.•Retrase más intentos de desfibrilación si la fibrilación ventricular (VF) persiste después de tres choques hasta que la temperatura central sea > 30 °C.•Por debajo de 30 °C, la adrenalina se acumulará y puede tener efectos más perjudiciales que beneficiosos. Dé 1 mg de adrenalina por vía intravenosa una vez para facilitar el ROSC a menos que esté planeando el inicio inminente de la ECPR. Aumente los intervalos de administración de adrenalina a 6-10 minutos si la temperatura central es de 30-35 °C.•Considere el uso de un dispositivo mecánico de RCP si el transporte se prolonga o cuando hay dificultades con el terreno.•Pronóstico hospitalario basado en el recalentamiento exitoso en la predicción del resultado de la hipotermia después de la puntuación de soporte vital extracorpóreo (HOPE).•Recalentamiento hipotérmico detenido pacientes con oxigenación de membrana extracorpórea veno-arterial (VA-ECMO).•Inicie el recalentamiento de soporte vital no extracorpóreo si no se puede llegar a un centro de ECPR en un tiempo razonable (por ejemplo, 6 h).
Rescate de avalanchas
•Inicio de base de la RCP en paro cardíaco en la temperatura central, el tiempo de entierro y la permeabilidad de las vías respiratorias
Trombosis
Embolia pulmonar
•Considere la embolia pulmonar en todos los pacientes con aparición repentina de disnea progresiva y ausencia de enfermedad cardíaca o pulmonar conocida.•Obtenga un ECG de 12 derivaciones (excluir el síndrome coronario agudo, busque la tensión del ventrículo derecho).•Identificar la inestabilidad hemodinámica y la embolia pulmonar de alto riesgo.•Realice una ecocardiografía al lado de la cama.•Iniciar la terapia anticoagulante (heparina 80 UI/kg IV) durante el proceso de diagnóstico, a menos que haya signos de sangrado o contraindicaciones absolutas.•Confirme el diagnóstico con angiografía pulmonar por tomografía computarizada.•Considere la embolectomía quirúrgica o el tratamiento dirigido por catéter como alternativa a la terapia fibrinolítica de rescate en pacientes que se deterioran rápidamente.
Paro cardíaco debido a una embolia pulmonar
•Los bajos valores de ETCO2 (<1,7 kPa/13 mmHg) mientras se realizan compresiones torácicas de alta calidad pueden apoyar un diagnóstico de embolia pulmonar, aunque es un signo inespecífico.•Use medicamentos fibrinolíticos para el paro cardíaco cuando la embolia pulmonar es la causa sospechosa de paro cardíaco.•Use medicamentos fibrinolíticos o embolectomía quirúrgica o trombectomía mecánica percutánea para el paro cardíaco cuando la embolia pulmonar es la causa conocida de paro cardíaco.•Considere la RCP como una terapia de rescate para pacientes seleccionados con paro cardíaco cuando la RCP convencional está fallando en entornos en los que se implementa.•Establecer un equipo multidisciplinario para tomar decisiones sobre el manejo de la embolia pulmonar de alto riesgo dependiendo de los recursos locales.
Trombosis coronaria
•Mejorar la educación sanitaria para reconocer los síntomas y minimizar los retrasos en la búsqueda de atención médica•Promover el entrenamiento de BLS para los posibles rescatadores de grupos de alto riesgo.•Fortalecer las redes regionales para garantizar la intervención coronaria percutánea (ICP) oportuna.•Transfiera al paciente a un centro con capacidad de ICP y active las redes STEMI existentes en caso de elevación del ST o sospecha de isquemia en curso.•En pacientes con ROSC y elevación ST sostenida en el ECG:ORealice una angiografía coronaria inmediata (y ICP si es necesario) dentro de los 120 minutos posteriores al diagnóstico.OConsidere la fibrinólisis en entornos prehospitalarios y no capaces de ICP si se espera un retraso mayor.•En pacientes con ROSC sostenido y sin elevación del ST en el ECG:OConsidere la angiografía coronaria inmediata (y la ICP si es necesario) si el paciente es hemodinámicamente inestable o muestra signos de isquemia en curso.OEn pacientes estables sin signos isquémicos, la evaluación de laboratorio de cateterismo cardíaco emergente no debe ser sistemática y puede retrasarse si no hay una alta probabilidad estimada de oclusión coronaria aguda.OEvaluar las causas no coronarias si el contexto clínico sugiere una etiología alternativa de la detención.OA menos que la reanimación en curso se considere inútil, transfiera a los pacientes sin ROSC sostenido con RCP en curso, a un centro de ICP para su consideración para angiografía o ECPR, dependiendo de los recursos disponibles y la experiencia del equipo.
valuar a todos los pacientes en paro cardíaco por posible intoxicación.•Reduzca la absorción, considere el uso de medidas de tratamiento específicas como antídotos, descontaminación y eliminación mejorada.•Administrar antídotos, cuando estén disponibles, lo antes posible.•Esté preparado para continuar la reanimación durante un período prolongado de tiempo, ya que la concentración de toxina puede caer a medida que se metaboliza o excreta durante medidas de reanimación prolongadas.•Consulte a los centros de envenenamiento regionales o nacionales para obtener información sobre el tratamiento del paciente envenenado.
Paro cardíaco traumático (TCA)
•El paro cardíaco traumático es diferente del paro cardíaco debido a causas médicas; esto se refleja en el algoritmo de tratamiento (
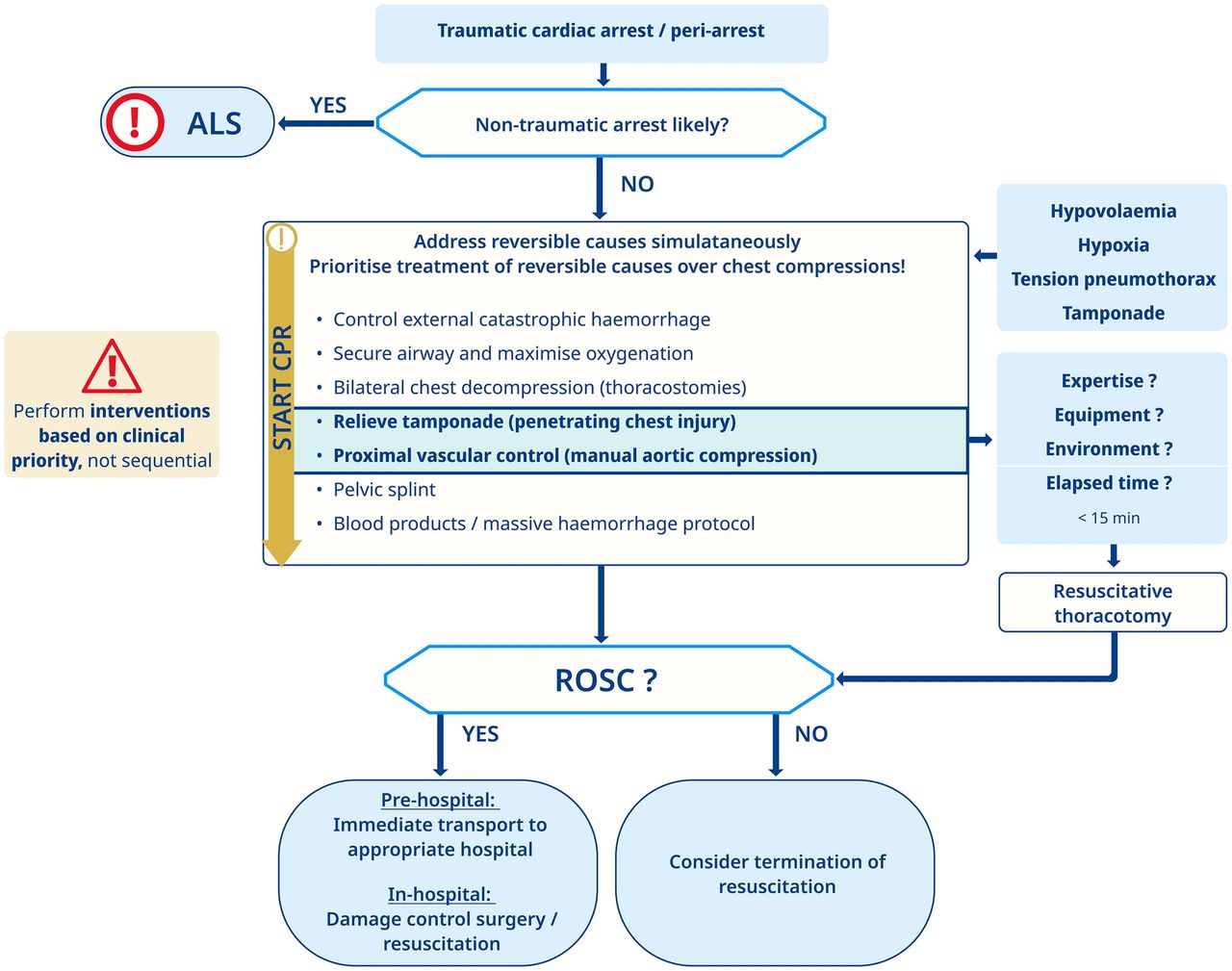
a respuesta al paro cardíaco traumático es de crita en el tiempo y el éxito depende de una cadena de supervivencia bien establecida, que incluya atención prehospitalaria y especializada en centros de trauma.•El manejo temprano y agresivo de causas reversibles (por ejemplo, control de hemorragias, manejo de las vías respiratorias, descompresión torácica) es esencial para la supervivencia.•La ecografía ayuda a identificar la causa del paro cardíaco y guía las intervenciones de reanimación.
Ajustes especiales
Paro cardíaco en el laboratorio de cateterismo
•Promover la capacitación adecuada del personal en habilidades técnicas y ALS, y considerar simulacros periódicos de emergencia.•Asegúrese de que el equipo de emergencia esté disponible y sea funcional.•Planifique los procedimientos electivos cuidadosamente para minimizar las posibles complicaciones y promover el uso de listas de verificación de seguridad.•Considere la ecocardiografía en caso de inestabilidad hemodinámica o sospecha de complicaciones.•Reanimar según el algoritmo de ELA, PERO modificar:OAplique 3 choques consecutivos en caso de ritmo impactante.OConsidere la estimulación externa o transvenosa para la bradicardia extrema.•Considere, en casos seleccionados dependiendo del contexto clínico, la experiencia y disponibilidad del equipo:ORCP mecánica, si la compresión manual no es factible o segura para el proveedor.ORCP extracorpórea en pacientes seleccionados con paro cardíaco refractario, especialmente si permite procedimientos críticos para corregir causas reversibles.ODispositivos de soporte circulatorio, para pacientes seleccionados en shock cardiogénico después de alcanzar el ROSC.
Ahogamiento
•Los rescatistas y los socorristas deben priorizar su seguridad y utilizar la técnica de rescate más segura.•El transeúnte debe pedir ayuda profesional y utilizar técnicas de rescate con las que se sientan seguros, según sus competencias.•Los socorristas deben usar material de rescate y dispositivos de flotación para los que están capacitados.•La inmovilización de la columna vertebral en agua no debe retrasar la extracción de la víctima del agua cuando se requiera reanimación.•Comience con 5 ventilaciones usando oxígeno inspirado al 100 % cuando esté disponible, continúe con el protocolo de RCP estándar.•Los equipos de vías respiratorias y ventilación se pueden utilizar cuando el proveedor está debidamente capacitado.•Aumente la presión de ventilación gradualmente cuando se necesite una alta presión de inspiración, para evitar la inflación del estómago.•Considere escalar a la ECPR si la reanimación inicial no tiene éxito, de acuerdo con los protocolos locales.•Siga las recomendaciones para la hipotermia.
Paro cardíaco en el quirófano (OR)
•Prevenir y mitigar el riesgo de paro cardíaco a través de la detección preoperatoria y la identificación de pacientes de alto riesgo, comunicación clara con los cirujanos sobre posibles procedimientos críticos, monitoreo avanzado y presencia continua de un anestesiólogo durante la inestabilidad del paciente.•Inicie las compresiones torácicas si la presión arterial sistólica disminuye repentinamente por debajo de 50 mmHg, en asociación con la caída en ETCO2, a pesar de las intervenciones apropiadas.•Informar al cirujano y al equipo de quirófano sobre el paro cardíaco.•Inicie compresiones torácicas de alta calidad y ajuste la altura de la mesa de operaciones para mejorar la eficiencia del trabajo.•Asegúrese de que las vías respiratorias estén seguras, revise el rastreo de ETCO2 y entregue una ventilación efectiva, administrando oxígeno al 100 %. Excluir la intubación esofágica no reconocida.•Utilice el ultrasonido para guiar la reanimación que aborda las causas reversibles.•Excluya el neumotórax por tensión.•Considere la ECPR temprana como una terapia para pacientes seleccionados cuando la RCP convencional está fallando.•Los profesionales de la salud capacitados pueden considerar la compresión cardíaca torácica abierta en casos específicos como una alternativa, si la ECPR no está disponible.•Los factores humanos son cruciales para mejorar la supervivencia del paro cardíaco intraoperatorio: garantizar la familiaridad con el equipo, asignar estrategias y roles durante los tiempos de espera del equipo quirúrgico e incluir el paro cardíaco perioperatorio en la capacitación del equipo multidisciplinario e interprofesional, la simulación in situ y los cursos de ELA.
Toxicidad sistémica de anestesia local
•Detenga el anestésico local si es posible.•Hiperventilar al paciente para aumentar el pH del plasma si hay acidosis metabólica.•Dar una dosis más baja de adrenalina (≤1 μg kg−1 en lugar de 1 mg de bolo IV)•Dar un bolo IV inicial de emulsión lipídica al 20 % a 1,5 ml kg-1 durante 1 minuto, seguido de una infusión a 0,25 ml kg-1 min-1, pero no exceder una dosis acumulada máxima de 12 ml kg-1 IV 20 % de emulsión lipídica.•Si el ROSC no se ha logrado a los 5 minutos, duplique la tasa de infusión de lípidos y administre un máximo de dos bolos lipídicos adicionales a intervalos de 5 minutos hasta que se haya logrado el ROSC.•Considere la reanimación prolongada (>1 h) y la ECPR•Tratar las convulsiones administrando benzodiazepinas
Cirugía cardíaca
•Confirme el paro cardíaco por signos clínicos y formas de onda de presión sin pulso.•Considere la ecografía para identificar las causas reversibles.•Proporcionar hasta 3 choques consecutivos en VF/pVT•Use la estimulación epicárdica a la salida máxima en la asístole o bradicardia extrema•Realice una re-esternotomía hasta 10 días después de la cirugía dentro de los 5 minutos, independientemente de la ubicación del paciente.•Proporcione compresiones cardíacas abiertas una vez que el pecho se vuelva a abrir.•Reducir la dosis de adrenalina intravenosa (0,05–0,1 mg)•Considere la ECPR para la reanimación prolongada o casos mínimamente invasivos en los que la reapertura puede retrasarse
Pacientes con dispositivo de asistencia ventricular izquierda (LVAD)
•Activar inmediatamente equipos especializados para pacientes inconscientes con LEVA.•Inicie la RCP mientras intenta simultáneamente restaurar la función del dispositivo si hay varios rescatistas disponibles.•Considere retrasar la RCP hasta 2 minutos para intentar restaurar el dispositivo si hay un solo rescatista presente.•Solucionar problemas del dispositivo como prioridad, siguiendo los protocolos pertinentes.
Paro cardíaco en los deportes
•La detección como prevención primaria juega un papel importante, pero sigue siendo controvertida.•Todas las instalaciones deportivas y de ejercicio deben realizar una evaluación de riesgos que considere la probabilidad y las consecuencias de un paro cardíaco y establecer estrategias de mitigación para reducir el riesgo.•Obtenga acceso inmediato y seguro al campo de juego.•Los programas de sensibilización en eventos deportivos han demostrado ser factibles para crear conciencia entre los grupos objetivo que aún no están involucrados en el paro cardíaco.
Servicios médicos de emergencia
•Los profesionales de la salud deben proporcionar reanimación en la escena en lugar de realizar el transporte en ambulancia con reanimación continua, a menos que haya una indicación apropiada para justificar el transporte (puente al tratamiento en el hospital).•Considere la RCP mecánica para el transporte con reanimación continua.•Considere la obtención de presión arterial invasiva para guiar la reanimación y la atención posterior a la reanimación ya en el entorno prehospitalario si es factible.•Los sistemas EMS deben utilizar el registro y los datos proporcionados a partir de los datos del equipo (por ejemplo, desfibriladores) para la información y la mejora continua de la calidad.
Paro cardíaco a bordo y reanimación por microgravedad
Paro cardíaco a bordo
•Se debe buscar ayuda profesional de la salud (anuncio en vuelo).•El rescatista debe arrodillarse en el espacio para las piernas frente a los asientos del pasillo para realizar compresiones torácicas si el paciente no puede ser transferido en pocos segundos a un área con espacio adecuado en el suelo (galería).•La RCP aérea es una opción posible en entornos de espacio limitado.•La gestión de las vías respiratorias debe basarse en el equipo disponible y en la experiencia del rescatista.•Si la ruta planificada conduce a un área donde no se puede llegar a ningún aeropuerto durante un período de tiempo más largo con alta posibilidad de ROSC durante una reanimación en curso, considere un desvío temprano.•Considere los riesgos de desvío si el ROSC es poco probable y dé las recomendaciones adecuadas a la tripulación de vuelo.•Si se cancela la RCP (sin ROSC) no hay necesidad médica de desvío de vuelo – siga la política de la aerolínea.
Reanimación por microgravedad
•El manejo de las vías respiratorias, la desfibrilación y el acceso IV/IO son similares a la ELA terrestre, pero solo una vez que el paciente está asegurado.•Considere la RCP mecánica•Consulte el soporte de telemedicina durante el paro cardíaco en órbita terrestre baja si es posible y la mano de obra lo permite.•El miembro de la tripulación con la calificación médica más alta debe decidir sobre la terminación de la reanimación, consultando el soporte de telemedicina.
Crucero
•Utilice todos los recursos de atención médica de inmediato (personal, equipo).•Active el servicio médico de emergencia en helicóptero si está cerca de la costa.•Considere el apoyo temprano de la telemedicina.•Tenga todo el equipo necesario para la ELA disponible a bordo.•En caso de que el número insuficiente de profesionales de la salud para tratar a CA, llame a más personal médico a través de un anuncio a bordo.
Grupos especiales de pacientes
Asma y enfermedad pulmonar obstructiva crónica
•Trate la hipoxia potencialmente mortal con oxígeno al 100 %.•Compruebe si hay evidencia de neumotórax (tensión).•Proporcionar intubación endotraqueal (debido a las altas presiones de inflación).•Considere la descompresión manual y la desconexión del ventilador para manejar la hiperinflación dinámica.•Considere la ECPR de acuerdo con los protocolos locales si los esfuerzos iniciales de reanimación no tienen éxito.
Paro cardíaco en pacientes con hemodiálisis
•Asignar a una enfermera o técnico de diálisis capacitado para operar la máquina de diálisis.•Detenga la diálisis y devuelva el volumen sanguíneo del paciente con un bolo de líquido.•Desconéctese de la máquina de diálisis (a menos que sea a prueba de desfibrilación) y tenga cuidado con las superficies mojadas.•Deje abierto el acceso a la diálisis y úselo para la administración de medicamentos.•Puede ser necesaria la diálisis en el período inicial posterior a la reanimación.
Reanimación en pacientes obesos
•Los pacientes obesos deben recibir un tratamiento de reanimación estándar, no se necesita ninguna desviación del BLS estándar y la ELA.
Reanimación en pacientes con pectus excavatum
•Considere la reducción de la profundidad de compresión torácica de 3-4 cm.•En el caso de una corrección de barra de Nuss, se requiere una fuerza sustancialmente mayor para proporcionar compresiones torácicas efectivas.•Considere la implementación temprana de la ECPR si las compresiones torácicas son ineficaces.•Utilice la colocación de la almohadilla anteroposterior para la desfibrilación utilizando energías estándar.
Paro cardíaco durante el embarazo
•Considere el embarazo en cualquier mujer colapsada en edad fértil.•Las mujeres embarazadas y periparto pueden deteriorarse a un paro cardíaco en cualquier lugar y las instalaciones y servicios médicos deben estar preparados para tales eventos.•Los sistemas de alerta temprana específicos de la obstetricia permiten el reconocimiento temprano de las pacientes embarazadas en deterioro.•Alivie la compresión aortocaval lo antes posible y manténgala durante toda la reanimación. Se sugiere el desplazamiento uterino izquierdo manual en el paro cardíaco materno debido a aspectos prácticos.•Abordar sistemáticamente las 4H y 4T y buscar causas específicas del embarazo de paro cardíaco, las 4P: preeclampsia y eclampsia, sepsis puerperal, complicaciones placentarias y uterinas y miocardiopatía periparto.•La histerotomía de reanimación es una intervención sensible al tiempo. La preparación para realizar el procedimiento debe realizarse con anticipación.•La histerotomía de reanimación debe realizarse lo antes posible en el lugar del paro cardíaco por un equipo capacitado.•La atención posterior a la reanimación en mujeres embarazadas y posparto requiere un enfoque multidisciplinario.
La evidencia que informa a las directrices
Causas especiales
Manejo y prevención del paro cardíaco debido a la anafilaxia
No existe una definición universalmente aceptada de anafilaxia. Es una reacción de hipersensibilidad sistémica aguda, generalmente de inicio rápido y puede ser fatal si no se maneja adecuadamente. El diagnóstico de anafilaxia es clínico.La incidencia estimada de anafilaxia es de 1,5 a7,9 por cada 100.000 personas al año en Europa.4 Los desencadenantes más comunes de las reacciones anafilácticas son los alimentos, los medicamentos y el veneno de himenóptero.5–7Esta guía sobre la anafilaxia se basa en las más recientes ILCOR CoSTR,8 directrices y actualizaciones del Comité de Anafilaxia de la Organización Mundial de Alergias,9 Academia Europea de Alergia e Inmunología Clínica,10 Parámetro de Práctica Norteamericana,11 Sociedad Australasiática de Inmunología Clínica y Alergia,12 los hallazgos del Proyecto de Auditoría Nacional del Reino Unido (NAP 7) de anafilaxia perioperatoria.13 La mayoría de estas recomendaciones se basan en datos de observación, declaraciones de buenas prácticas y consenso de expertos.
Reconocimiento de la anafilaxia
Según el Comité de Anafilaxia de la Organización Mundial de Alergias, la anafilaxia es probable cuando se cumple al menos uno de los siguientes criterios9:1.Inicio agudo en cuestión de minutos a varias horas, con afectación simultánea de la piel, el tejido mucoso o ambos (por ejemplo, urticaria generalizada, prurito o enrojecimiento, labios hinchados, lengua o úvula) y uno de los siguientes:A.Compromiso respiratorio (por ejemplo, disnea, sibilancias/broncoespasmo, estridor, flujo espiratorio máximo reducido, hipoxemia)B.Presión arterial reducida o síntomas asociados de disfunción de órganos terminales (por ejemplo, hipotonía, síncope, incontinencia)C.Síntomas gastrointestinales graves (por ejemplo, cólicos abdominales severos, vómitos repetitivos), especialmente después de la exposición a alérgenos no alimentarios2.Inicio agudo de hipotensión o broncoespasmo o afectación laríngea después de la exposición a un alérgeno conocido o altamente probable para ese paciente (minutos a varias horas), incluso en ausencia de afectación típica de la piel.La anafilaxia puede ocurrir sin ninguna afectación de la piel o con afectación de la piel remota al sitio de exposición, y una reacción anafiláctica puede presentarse inicialmente solo con afectación respiratoria o cardiovascular. Durante la anestesia general o la ventilación mecánica en entornos de emergencia o cuidados intensivos, la anafilaxia puede manifestarse clínicamente a través de un aumento repentino de las presiones de ventilación y una espiración prolongada, combinada con una disminución de la presión arterial, con o sin cambios en la piel y la mucosa.El reconocimiento temprano de los síntomas que sugieren una reacción anafiláctica, debe provocar una reacción inmediata.
El enfoque inicial si se sospecha una reacción anafiláctica
Detenga o retire el gatillo si es posible – detenga o elimine cualquier desencadenante potencial o probable. No retrase el tratamiento si no es factible quitar el gatillo.Asegúrese de que el paciente esté acostado – no siente ni se ponga de pie al paciente – la anafilaxia fatal se ha asociado con la postura erguida o el paciente sentado/de pie.14-16 Posicione a los pacientes de acuerdo con sus síntomas y considere específicamente:OPosición supina con las piernas levantadas, para mejorar el retorno venoso.OPosición sentada con las piernas estiradas si los síntomas de las vías respiratorias o de la respiración están presentes sin problemas de circulación.
Dar adrenalina
Administrar adrenalina IM como medicamento de primera línea para el manejo de la anafilaxia.17 La adrenalina IM inicial tiene como objetivo proporcionar apoyo hemodinámico y actuar para inhibir la desgranulación de los mastocitos. El sitio preferido es el lateral de la mitad del muslo,18 la dosis estándar para adultos es de 0,5 mg.10 Esto debe repetirse después de 3-5 minutos, según la respuesta clínica.19 Los autoinyectores o los aplicadores de adrenalina intranasal se pueden usar para la autoadministración temprana o la inyección por un rescatador. Si los síntomas no se resuelven o el paciente está en un área monitoreada, por ejemplo, la unidad de cuidados intensivos (UCI), la sala de operaciones (OR), el departamento de emergencias (ED), la administración intravenosa de adrenalina, comenzando con una dosis de 0,1 µg kg−1 min-1 titulado de acuerdo con la respuesta, puede ser administrado por personal debidamente capacitado cuando los pacientes son completamente monitoreados.20En un paciente con obstrucción de las vías respiratorias superiores o broncoespasmo, considere agregar adrenalina nebulizada.10,21 Sin embargo, la absorción sistémica de adrenalina inhalada es mínima y no debe retrasar la administración concurrente de adrenalina en el IM.22
Acceso vascular seguro – administrar líquidos intravenosos
La anafilaxia puede resultar en hipovolemia grave debido a la vasodilatación periférica y al aumento de la permeabilidad vascular (shock distributivo).23,24La reanimación con líquidos es esencial, además del efecto vasoconstrictor de la adrenalina. Inmediatamente después de la primera dosis de adrenalina, asegúrese de un acceso vascular adecuado (por ejemplo, catéter intravenoso de gran oricular, acceso intraóseo). Administre solución cristaloide en dosis de bolo de 10-20 ml kg-1 y repita según la respuesta del paciente. Se pueden requerir grandes volúmenes de fluidos para restaurar la estabilidad hemodinámica.
Dar oxígeno
Proporcione 15 L min-1 100 % de oxígeno a cada paciente con una reacción anafiláctica y titule a una saturación de oxígeno dirigida al 94-98 %.25
Otros medicamentos para apoyar la circulación
En el caso de que no haya respuesta a la adrenalina, considere la administración de un segundo medicamento vasoactivo, como la noradrenalina o la vasopresina.10,21
Papel de los esteroides y antihistamínicos en el manejo de la anafilaxia
Los antihistamínicos H1 antagonizan la acción proinflamatoria de la histamina, que puede aliviar los síntomas cutáneos de la liberación de histamina. Sin embargo, su inicio de acción es lento, y no deben retrasar la administración de adrenalina.Precaución: La administración intravenosa rápida de antihistamínicos H1 de primera generación puede causar o exagerar la hipotensión.26La administración de corticosteroides para prevenir síntomas prolongados o reacciones bifásicas se ha basado en evidencia de baja certeza.27,28 Estudios recientes indican un mayor riesgo de resultados negativos (segunda dosis de adrenalina, hospitalización o ingreso en la UCI) en pacientes tratados con corticosteroides en el entorno prehospitalario.29,30 Basado en la opinión de los expertos, el ERC no recomienda el uso rutinario de corticosteroides en el manejo de reacciones anafilácticas.
Consideraciones para el paro cardíaco en la anafilaxia
En una serie de casos de paro cardíaco perioperatorio, el 94 % de los pacientes con paro cardíaco anafiláctico tuvieron actividad eléctrica inicial sin pulso.13El consenso de los expertos es seguir el protocolo estándar de ELA, incluida la administración de adrenalina intravenosa y la corrección de causas reversibles relevantes, en particular la hipovolemia y la hipoxia. Considere la ECPR en casos de paro cardíaco refractario, específicamente en hospitales donde esto se puede implementar.8
Hiper/hipopotasemia y otros trastornos electrolíticos
Las anomalías electrolíticas son una causa reconocida de arritmias y paro cardíaco, los trastornos del potasio (hiperpotasemia e hipopotasemia) son los más comunes en la práctica clínica y se ha demostrado una asociación en forma de U entre el K+ sérico y la mortalidad.31La hiperpotasemia también ha sido objeto de una revisión reciente de ILCOR (2025).32
Hiperpotasemia – paro no cardíaco
La hiperpotasemia ocurre en el 1-10 % de los pacientes hospitalizados.33-35 En pacientes con enfermedad renal crónica (ERC), la hiperpotasemia resulta en un riesgo significativamente mayor de eventos adversos cardiovasculares mayores y arritmias en el hospital en comparación con los pacientes sin hiperpotasemia.36 Los pacientes en diálisis también son más propensos a la hiperpotasemia grave que los pacientes sin diálisis (45,8 % frente a 10,3%) durante la hospitalización.35 La mortalidad hospitalaria es significativamente mayor en los pacientes con hiperpotasemia (18,1%) en comparación con aquellos con hipopotasemia (5 %) o normocalemia (3,9 %).33 La mortalidad hospitalaria es 3,9 veces mayor en pacientes con un K+ sérico > 6,5 mmol L-1 en comparación con losLa enfermedad renal y cardíaca a menudo coexisten y estos pacientes tienen un alto riesgo de hiperpotasemia exacerbada por la terapia farmacológica (por ejemplo, inhibidores de la ECA, antagonistas de la angiotensina II y antagonistas de los receptores mineralocorticoides). Sin embargo, la baja titulación o la interrupción de estos medicamentos en respuesta a la hiperpotasemia se asocia con peores resultados para los pacientes.38-40 Ahora hay un papel para los aglutinantes de potasio (ciclosilicato de circonio de sodio y patirómero) para proporcionar terapia protectora cardiorrenal.41,42La hiperpotasemia es evidente con una concentración de potasio sérico (K+) superior a 5,5 mmol/l, aunque la hiperpotasemia es un continuo, y su gravedad guía el tratamiento. La hiperpotasemia se clasifica como «leve» (K+ 5,5–5,9 mmol L−1), ‘moderada’ (K+ 6,0–6,4 mmol L−1), ‘grave’ (K+ ≥ 6,5 mmol L−1) o ‘extrema’ (K+ ≥ 9,0 mmol L−1).El riesgo de hiperpotasemia aumenta con múltiples factores de riesgo simultáneos (por ejemplo, uso concomitante de ACE-I y/o antagonista del receptor mineralocorticoide (MRA) en presencia de ERC).
Diagnóstico de hiperpotasemia
Considere la hiperpotasemia en todos los pacientes en riesgo (por ejemplo, insuficiencia renal, insuficiencia cardíaca, diabetes mellitus, enfermedad hepática crónica) con una arritmia o paro cardíaco. La debilidad de las extremidades, la parálisis flácida o la parestesia pueden ser indicadores de hiperpotasemia grave.Confirme la hiperpotasemia utilizando pruebas de punto de atención, ya que las muestras de laboratorio formales llevarán tiempo.43-45Los cambios en el ECG pueden reflejar la gravedad y la tasa de aumento del K+ sérico,46,47, pero puede ser normal incluso en hiperpotasemia grave. Cuando el diagnóstico de hiperpotasemia se puede establecer en base al ECG, el tratamiento puede iniciarse antes de que el resultado de laboratorio esté disponible.46 Estos signos de hiperpotasemia en el ECG pueden desarrollarse progresivamente e incluir (Fig. 11a):•Ondas T altas y con pico (en tienda) (es decir, Onda T más grande que la onda R en más de un cable);•Bloqueo cardíaco de primer grado (intervalo PR prolongado > 0,2 s);•Ondas P aplanadas o ausentes;•QRS ensanchado (>0,12 s);•Onda sinusoidal;•Taquicardia ventricular;•Bradicardia;•Paro cardíaco (PEA, VF/VT, asistole).
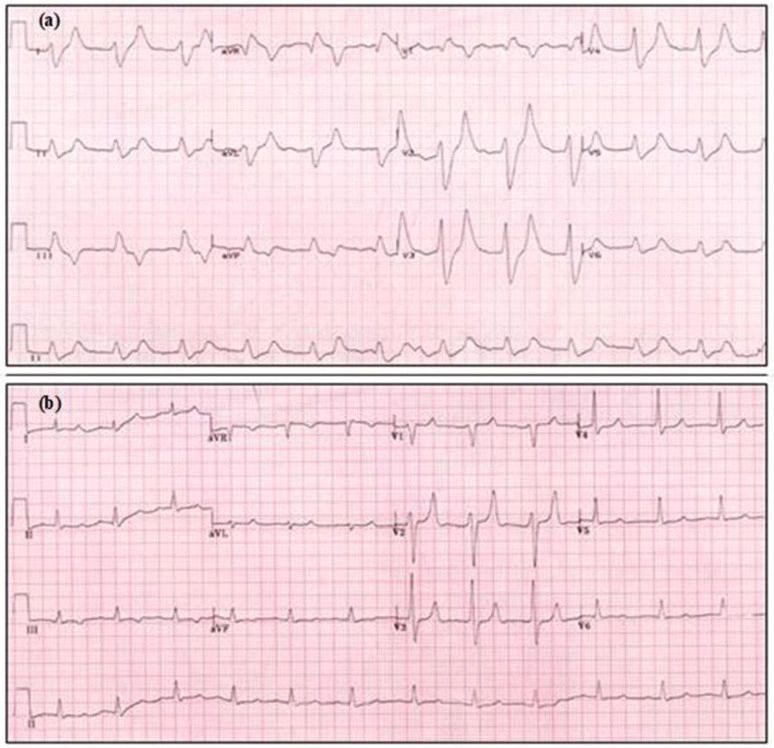
En pacientes con hiperpotasemia grave, se ha demostrado que ocurren arritmias o paro cardíaco en el 15 % de los pacientes dentro de las 6 horas posteriores al ECG de presentación.46 Por lo tanto, los retrasos en el tratamiento pueden tener consecuencias graves.
Tratamiento de emergencia de la hiperpotasemia
El tratamiento se guía por la gravedad de la hiperpotasemia y la presencia de cambios en el ECG. Evite el retraso en el inicio de los tratamientos hipopotásicos (es decir, insulina-glucosa, salbutamol y ciclosilicato de circonio de sodio). Siga un enfoque sistemático como se describe en el algoritmo de tratamiento de la hiperpotasemia (Fig. 2). El tratamiento de la hiperpotasemia leve no está dentro del alcance de esta directriz. Tanto Cochrane como ILCOR han realizado revisiones sistemáticas del tratamiento farmacológico de la hiperpotasemia.32,48,49
Insulina y glucosa
Esta es la terapia reductora de K+ más efectiva y confiable que funciona cambiando K+ a las células. Se ha demostrado que la dosis convencional de insulina soluble (10 unidades) reduce el K+ sérico en 0,7-1,4 mmol L-1,32,50 Los estudios han sugerido un posible efecto dependiente de la dosis de la insulina51-55 y una posible correlación entre la gravedad de la hiperpotasemia y el grado de reducción de K+ con 10 unidades de insulina.56 Estos hallazgos son particularmente relevantes en el entorno de reanimación.La hipoglucemia sigue siendo un riesgo iatrogénico importante con una incidencia reportada de hasta 28 %.53,57-62 Reducir la dosis de insulina (5 unidades) no redujo significativamente el riesgo de hipoglucemia (glucemia en sangre < 4 mmol L−1).51,53,60,61 Una revisión de alcance (n= > 15.000) encontró que el factor de riesgo más consistente para la hipoglucemia es un bajo valor de glucosa en sangre previa al tratamiento.63 Un umbral de < 7 mmol L−1 de glucosa en sangre ha sido constantemente para identificar a los pacientes con mayor riesgo de hipoglucemia iatrogénica.55,64-67 En un estudio, la administración de 50 g de glucosa durante 4 horas resultó en hipoglucemia en el 6,1 % de los pacientes.59 Basado en estos hallazgos colectivos y en la evidencia de que esta estrategia es efectiva,68 Se ha desarrollado un protocolo modificado que se recomienda en el algoritmo ERC (Fig. 2) para reducir la hipoglucemia iatrogénica.50
Salbutamol
El salbutamol es un agonista de los receptores de adrenoceptores beta-2 y promueve el cambio intracelular de K+. Un metaanálisis que incluyó siete estudios que administraron 10-20 mg de salbutamol inhalado demostró una reducción en el K+ sérico en 0,9 mmol L-1 en 120 min.32 Los primeros estudios sugirieron que el salbutamol puede ser menos efectivo en pacientes que reciben betabloqueantes no selectivos y en hasta el 40 % de los pacientes con enfermedad renal terminal.69,70 Sobre esta base, no se ha aconsejado la monoterapia. Los estudios que combinan agonistas de insulina-glucosa y beta-2 fueron más efectivos que cualquiera de los tratamientos solos.69,70 La revisión de ILCOR señaló una reducción de K+ de 1,2 mmol L-1 con terapia combinada y apoyó el uso de ambos medicamentos.32 Por lo tanto, el ERC recomienda la administración simultánea de agonistas de insulina-glucosa y beta-2 para reducir los valores de potasio. La insulina-glucosa y el salbutamol son efectivos durante 4-6 horas, después de lo cual puede ocurrir una hiperpotasemia de rebote.
Sales de calcio intravenosas (cloruro de calcio o gluconato)
El calcio intravenoso se ha utilizado durante décadas para el tratamiento de la hiperpotasemia, particularmente en presencia de cambios de ECG, a pesar de la falta de evidencia clínica. Un reciente ensayo aleatorio sugirió daños por el uso rutinario de calcio IV durante la OHCA; sin embargo, los pacientes con hiperpotasemia fueron excluidos.71 En la práctica de la reanimación, el uso de calcio IV se ha restringido al tratamiento de trastornos electrolíticos (es decir, hiperpotasemia, hipocalcemia, hipermagnesemia) y sobredosis de bloqueador de canales de calcio. En la práctica clínica, la mejora en los cambios del ECG después del calcio IV se puede ver incluso antes de que los medicamentos hipotores de K+ hayan hecho efecto (Fig. 11).La justificación para el uso de calcio IV en la hiperpotasemia e hipermagnesemia es el «antagonismo» de su efecto sobre el músculo cardíaco y esquelético (es decir, la estabilización de la membrana), pero la eficacia puede estar influenciada por la dosis y la tasa de administración. Se ha propuesto un mecanismo alternativo en un estudio en animales en el que se demostró que el calcio IV restaura la «conducción», lo que resulta en una mejora de los cambios de ECG inducidos por hiperpotasemia.72 En la preeclampsia, el calcio IV mejora la debilidad de las extremidades, la depresión respiratoria y los efectos cardíacos inducidos por la hipermagnesemia iatrogénica.73La reciente revisión sistemática de ILCOR incluyó solo un estudio de paro no cardíaco de calcio IV en adultos y no encontró evidencia que respalde un efecto clínico del calcio IV en la hiperpotasemia, aunque se consideró que el estudio tenía un riesgo crítico de sesgo.32Las revisiones Cochrane no incluyeron estudios que evalúen el efecto del calcio IV, pero sugirieron que no se recomienda la retención de calcio IV en pacientes con hiperpotasemia grave o cambios de ECG o ambos, dadas las consecuencias potencialmente mortales.48 Actualmente no hay pruebas suficientes a favor o en contra del uso de calcio IV en el tratamiento de la hiperpotasemia, por lo que el ERC continúa recomendando la administración de calcio IV a los pacientes con mayor riesgo de arritmias (es decir, hiperpotasemia grave con cambios de ECG presentes).
Bicarbonato de sodio
La revisión de ILCOR incluyó cinco estudios en adultos que usaron dosis variables de bicarbonato (50-390 mmol) y encontró una reducción de K+ de solo 0,1 mmol L-1 en 60 min.32 La revisión Cochrane también concluyó que no hay evidencia que respalde el uso de bicarbonato de sodio en la hiperpotasemia.48,49 Por lo tanto, el ERC recomienda el uso rutinario de bicarbonato de sodio en el tratamiento de la hiperpotasemia en casos no cardíacos.
Aglutinantes de potasio
Los nuevos aglutinantes de potasio no se incluyeron en la revisión de ILCOR, pero el ciclosilicato de circonio de sodio (SZC) y el patiromero son bien tolerados y tienen un papel tanto en la hiperpotasemia aguda como crónica. SZC tiene un inicio de acción más rápido (dentro de 1 h) que Patiromer.74 En 48 h, SZC reduce el K+ sérico en 1,1 mmol/l y muestra una mayor eficacia con niveles más altos de potasio (reducción de K+ de 1,5 mmol/l en pacientes con un K+ sérico > 6,0 mmol/l).
Indicaciones para la diálisis
La diálisis es el tratamiento más definitivo para la hiperpotasemia, y las principales indicaciones con hiperpotasemia son:•Hiperpotasemia grave que amenaza la vida con o sin cambios en el ECG o arritmia;•Hiperpotasemia resistente al tratamiento médico;•Enfermedad renal terminal;•Lesión renal aguda oligúrica (salido de orina < 400 ml/día);•Descomposición marcada del tejido (por ejemplo, rabdomiólisis).Después de la diálisis, también puede ocurrir hiperpotasemia de rebote.
Entorno prehospitalario e hiperpotasemia
El manejo e identificación de pacientes con hiperpotasemia en el entorno prehospitalario puede ser difícil, debido a las limitadas opciones de diagnóstico.
Reanimación del paro cardíaco hipercalémico
La hiperpotasemia es el trastorno metabólico más común asociado con el paro cardíaco y es potencialmente reversible, con una incidencia de IHCA reportada del 1 %75 al 12 %,76 con PEA como el ritmo de detención inicial más común.77 La revisión de ILCOR incluyó solo un estudio de hiperpotasemia en el paro cardíaco (alto riesgo de sesgo debido al tiempo de reanimación). Esta revisión describe la disminución de las tasas de ROSC con calcio, bicarbonato de sodio o ambos.32Un estudio de IHCA hipercalémico (n = 109; K+ sérico medio 7,8 mmol L-1) utilizó calcio IV y bicarbonato de sodio 76 en una población muy heterogénea y alcanzó el 36,7 % de ROSC, pero solo el 12,8 % sobrevivió > 24 h y el 3,7 % sobrevivió al alta hospitalaria. Dado el mal resultado en pacientes con hiperpotasemia extrema, los autores propusieron que la diálisis podría ser una opción.La diálisis es el tratamiento definitivo para la hiperpotasemia, pero rara vez se utiliza en el paro cardíaco. Una revisión de los informes de casos de diálisis durante la RCP muestra resultados exitosos en pacientes con un K+ sérico que oscila entre 8,2 y 10,2 mmol L-1,50 Todas las modalidades de diálisis (con y sin ECMO) se han utilizado durante la RCP, lo que demuestra que es técnicamente factible.78-81 La duración media de la diálisis para lograr el ROSC fue de 45,4 min (rango 15-95 min) y la reducción media en el K+ sérico fue de 3,2 mmol L-1, lo que sería difícil de lograr solo con medicamentos, particularmente durante el paro cardíaco.50 La gravedad de la hiperpotasemia parece ser un buen indicador de la probabilidad de lograr y mantener el ROSC. Se ha informado de un protocolo para el inicio de la diálisis durante la RCP.50Un estudio que evaluó el resultado de la OHCA después del tratamiento médico antihiperpotasémico (n = 465; K+ promedio 6,9 mmol L−1, IQR 5,7–8,4 mmol L−1) no encontró ningún efecto en el ROSC, a pesar de lograr la reducción de K+ (K+ promedio 5,4 mmol L−1, IQR 4,4–6,8 mmol L−1).82 Actualmente no hay pruebas suficientes a favor o en contra del uso de calcio IV en el tratamiento de la hiperpotasemia, por lo tanto, el ERC continúa recomendando la administración de calcio IV a pacientes con paro cardíaco hipercalémico en todos los entornos.
Hipopotasemia
La hipopotasemia se define como un suero K+ < 3,5 mmol L-1 [leve (K+ 3,0-3,4 mmol L−1), moderado (K+ 2,5-2,9 mmol L-1) o grave (K+ < 2,5 mmol L-1 o sintomático].83 Suele ser causada por la pérdida excesiva de K+, el desplazamiento transmembrana de K+ a las células o la reducción de la ingesta de K+.84 La hipopotasemia se asocia con una mayor mortalidad hospitalaria y un mayor riesgo de arritmias ventriculares. Los riesgos aumentan en pacientes con cardiopatía preexistente,85,86 aquellos tratados con digoxina87 o aquellos sometidos a una intervención coronaria percutánea primaria para el infarto de miocardio con elevación del segmento ST.88 En la insuficiencia cardíaca aguda, la hipopotasemia puede estar asociada con un aumento de la mortalidad por todas las causas a corto y largo plazo después del alta hospitalaria.89
Tratamiento de la hipopotasemia
El tratamiento se guía por la gravedad de la hipopotasemia y la presencia de síntomas y/o anomalías del ECG, como se ilustra en la Fig. 3. Es preferible el reemplazo lento del potasio, pero en caso de emergencia, se requiere un reemplazo rápido por vía intravenosa, preferible a través de la ruta central. El nivel objetivo es de 4 mmol L-1K+.90 La corrección de cualquier hipomagnesemia concomitante es esencial. La deficiencia de magnesio concomitante es común en pacientes con hipopotasemia. La reposición de magnesio facilitará una corrección más rápida de la hipopotasemia.91 Busque asesoramiento de expertos para el reemplazo de potasio en pacientes con insuficiencia renal grave (ver Fig. 3).
Trastornos de calcio y magnesio
Hipertermia e hipertermia maligna
La hipertermia es el resultado de una temperatura corporal por encima de lo normal (temperatura central 36,5-37,5 °C) debido a la termorregulación fallida. Los extremos de la edad y la multimorbilidad son factores de riesgo específicos.92,93La hipertermia maligna es un raro trastorno farmacogenético de la homeostasis del calcio del músculo esquelético caracterizado por contractura muscular y crisis hipermetabólica potencialmente mortal después de la exposición de individuos genéticamente predispuestos a anestésicos halogenados, succinilcolina o neurolépticos.94,95 Rara vez, la hipertermia maligna puede desencadenarse de forma no farmacológica. Los signos y síntomas clínicos más comunes incluyen hipercapnia (34 %), taquicardia sinusal (25 %), hipertermia (20 %), espasmo massetero (11 %), rigidez muscular generalizada (3 %), acidosis, hiperpotasemia y muerte si no se trata.96 Esta sección se basa en dos revisiones sistemáticas, cinco revisiones no sistemáticas y dos revisiones de alcance, esta última realizada más recientemente el 15 de junio de 2024.94-101
Hipertermia
La hipertermia asociada al medio ambiente (temperatura central > 38 °C) se puede evitar mediante la aclimatación, la hidratación adecuada y la evitación de la actividad física en climas cálidos.92,98,102 El principal factor de riesgo es la deshidratación, que corre el riesgo de progresión a síncope por calor, agotamiento por calor, golpe de calor y, finalmente, disfunción de órganos múltiples y paro cardíaco. Tratamiento de la hipertermia ver Fig. 4 y Tabla 3. La temperatura central debe medirse centralmente (por ejemplo, tímpana, rectal, esofágica) para guiar el tratamiento.103
Hipertermia maligna
La prevención de la hipertermia maligna es clave; es una enfermedad genética que, si no se trata, resulta en la muerte.97,108,109 Los medicamentos como la 3,4-metilendioximetanfetamina (MDMA, ‘éxtasis’) y las anfetaminas también pueden causar una condición similar a la MH y el uso de dantroleno también puede ser terapéutico en estos casos.110 Siempre considere la hipertermia maligna, con aumentos inexplicables e inesperados en ETCO2, frecuencia cardíaca o temperatura. Más información sobre el manejo de la hipertermia maligna (ver código QR. 1).94.111Brevemente, detenga la exposición, proporcione oxígeno de alto flujo, dé dantroleno hasta ETCO2 < 45 mmHg (6 kPa) con ventilación mínima normal y temperatura central < 38,5 °C, enfríe al paciente. Si se produce un paro cardíaco, siga el algoritmo universal de ELA y continúe enfriando al paciente. Aplique las mismas técnicas de enfriamiento que para el manejo específico de la temperatura de la atención posterior a la reanimación (ver Fig. 5).Es esencial ponerse en contacto con un centro experto de hipertermia maligna para obtener asesoramiento continuo.97-112 El dantroleno debe almacenarse de forma centralizada donde se proporciona anestesia, y los algoritmos para el manejo de la MH deben estar fácilmente disponibles (ver código QR 1).
Hipertermia inducida por toxinas
La intoxicación puede presentarse con hipertermia como un signo temprano. El riesgo es mayor en personas que toman drogas psicotrópicas (para tratamiento o recreación), simpaticomiméticos, anticolinérgicos, salicilatos, medicamentos para perder peso o después de la ingestión de hongos silvestres.Llevar a cabo un enfoque inicial de ABCDE después de aplicar el equipo de protección personal (EPP) apropiado, como en todos los casos de agentes tóxicos desconocidos. Los síntomas específicos y el historial del paciente pueden ayudar a identificar la sustancia sospechosa, incluso antes de que los resultados toxicológicos estén disponibles. Para la mayoría de los casos de hipertermia inducida por veneno, el tratamiento sintomático rápido es clave. Enfriamiento activo y estrategias específicas para síntomas específicos: benzodiazepinas para reducir la agitación y el temblor, dantroleno para la contracción y rigidez muscular, y medidas para reducir las concentraciones de toxinas
Hipotermia accidental y rescate de avalanchas
La hipotermia accidental se define como una disminución en la temperatura central < 35 °C, durante la cual los signos vitales y la conciencia se desvanecen y finalmente desaparecen.150 Sin embargo, los signos vitales pueden ser mínimos, pero aún están presentes con temperaturas < 24 °C.En pacientes hipotérmicos con circulación espontánea, las intervenciones clave son el aislamiento y el triaje hospitalario seguido de transferencia y recalentamiento. En pacientes hipotérmicos con paro cardíaco, las intervenciones clave son la RCP continua y el calentamiento del soporte vital extracorpóreo. Estas medidas pueden resultar en un buen resultado neurológico incluso con un flujo prolongado sin flujo o bajo (es decir, RCP) veces, si la hipotermia (p. ej. < 30 °C) que se produjo antes del paro cardíaco. Una revisión de alcance hasta el 13 de febrero de 2025 encontró tres revisiones sistemáticas para esta recomendación,151-153, pero también incluyó otros artículos relevantes.150,154-161
Prevención del paro cardíaco
La hipotermia accidental primaria es inducida por la exposición al frío, mientras que la hipotermia accidental secundaria se desencadena por la enfermedad y otras causas externas. La hipotermia primaria es común en actividades al aire libre (principalmente atletas y personas perdidas) y entornos urbanos (por ejemplo, personas sin hogar e intoxicadas), mientras que la incidencia de hipotermia secundaria está aumentando entre las personas mayores y multimórbidas en el entorno interior.154,157Medir la temperatura central con un termómetro de baja lectura es el estándar de oro para el diagnóstico de hipotermia157:•tímpano en pacientes que respiran espontáneamente y•esofágico en pacientes con un tubo traqueal o vía aérea supraglótica in situ.159Si no se puede medir la temperatura central, la temperatura debe evaluarse de acuerdo con el nivel de conciencia con el Sistema de Estadificación Suizo Revisado.156 (Tabla 5 y Fig. 12).•En el Sistema Suizo Revisado, «Alerta» corresponde a una puntuación GCS de 15; «Verbal» corresponde a una puntuación GCS de 9-14, incluidos los pacientes confundidos; «Doloroso» e «Inconsciente» corresponden a una puntuación GCS < 9. Si bien el temblor no se utiliza como un signo que define la etapa en el Sistema Suizo Revisado, su presencia generalmente significa que la temperatura es > 30 °C, una temperatura a la que es poco probable que ocurra un paro cardíaco hipotérmico.•Sin respiración aparente, sin pulso palpable carótido o femoral aparente, sin presión arterial medible – comprobar si hay signos de vida (pulso y, especialmente, respiración) durante hasta 1 minuto.•La transición de colores entre etapas representa la superposición de pacientes dentro de los grupos. El riesgo estimado de paro cardíaco se basa en que la hipotermia accidental es la única causa de los hallazgos clínicos (Fig. 12). Si otras condiciones perjudican la conciencia, como la asfixia, la intoxicación, el edema cerebral a gran altitud o el trauma, el Sistema Suizo Revisado puede predecir falsamente un mayor riesgo de paro cardíaco debido a la hipotermia. Se debe tener precaución si un paciente permanece «alerto» o «verbal» mostrando signos de inestabilidad hemodinámica o respiratoria, como bradicardia, bradipnea o hipotensión, ya que esto puede sugerir la transición a una etapa con mayor riesgo de paro cardíaco.
EscenarioHallazgos clínicosTemperatura central (°C) (si está disponible)
Hipotermia I (leve)Consciente*35–32 °C
Hipotermia II (moderada)Conciencia deteriorada*<32–28 °C
Hipotermia III (grave)Inconsciente*; signos vitales presentes<28 °CH
ipotermia IV
(grave)
Muerte aparente;
Signos vitales ausentesVariable**

Los pacientes hipotérmicos deben ser protegidos del ambiente frío a través de una exposición y aislamiento mínimos y ser trasladados lo más rápido posible al siguiente hospital apropiado para su recalentamiento. Aunque no es dañino, el recalentamiento activo no es práctico durante períodos de transporte breves (por ejemplo, menos de 1 h).153 Los pacientes hipotérmicos con inestabilidad cardíaca prehospitalaria (es decir, frecuencia cardíaca < 45/min, presión arterial sistólica < 90 mmHg, arritmia ventricular, temperatura central < 30 °C) deben volver a calentarse en el hospital utilizando técnicas mínimamente invasivas con una consulta oportuna con un centro de ECMO siendo esencial.156,161
Manejo del paro cardíaco
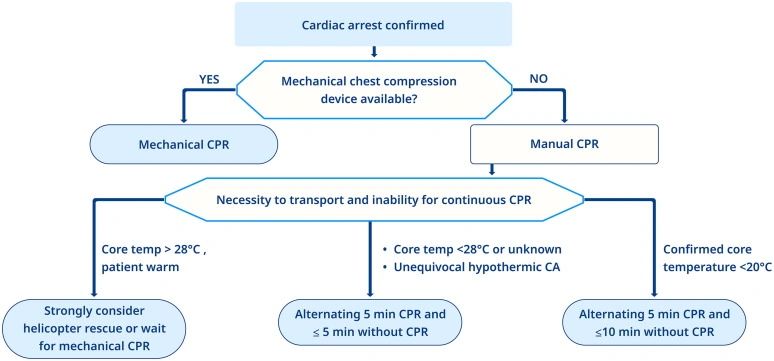
La temperatura publicada más baja a partir de la cual se ha logrado una reanimación y recalentamiento exitosas es actualmente de 11,8 °C155 para hipotermia accidental y 4,0 °C para hipotermia inducida.162 Una revisión sistemática informó de solo cinco pacientes (28-75 años de edad) que habían sido arrestados a una temperatura central corporal > 28 °C, lo que sugiere que el paro cardíaco causado por hipotermia primaria a ≥ 28 °C es posible, pero poco probable.151 Algunos pacientes todavía pueden tener signos vitales mínimos a una temperatura central < 24 °C.163Compruebe si hay signos de vida durante un minuto, no solo mediante un examen clínico, sino también mediante ECG y ultrasonido.164En el paro cardíaco hipotérmico, se debe recopilar información relevante sobre el resultado para estimar la probabilidad de supervivencia del paro cardíaco hipotérmico con el HOPE (Predicción del resultado de la hipotermia después del recalentamiento de ECLS para pacientes detenidos hipotérmicos) – puntuación.158,160,165El pronóstico de los pacientes con paro cardíaco hipotérmico primario puede ser excelente,157 mientras que en casos de hipotermia secundaria el resultado está más influenciado por la comorbilidad.166 Los pacientes hipotérmicos en paro cardíaco presenciado y no presenciado tienen buenas posibilidades de recuperación neurológica si la hipotermia se desarrolló antes de la hipoxia y el paro cardíaco, y si la cadena de supervivencia funcionó bien.151,152,166 La hipotermia disminuye la demanda de oxígeno del cuerpo (6-7 % por 1 °C de enfriamiento) y, por lo tanto, protege los órganos más dependientes del oxígeno del cuerpo (cerebro y corazón) contra el daño hipóxico.167 Una revisión sistemática de pacientes con paro cardíaco hipotérmico presenciados (n = 214) informó una tasa de supervivencia al alta hospitalaria de 73 %, con el 89 % de los sobrevivientes teniendo un resultado neurológico favorable. Una revisión sistemática de pacientes con paro cardíaco hipotérmico no testigos (n = 221) informó una tasa de supervivencia del 27 %, con un 83 % de los sobrevivientes teniendo un resultado neurológico favorable. A tener en cuenta que el primer ritmo fue la asístole en el 48 % de estos supervivientes.152Los pacientes con paro cardíaco hipotérmico deben recibir RCP continua hasta que se haya restablecido la circulación. La compresión torácica y la tasa de ventilación deben seguir el algoritmo estándar de ELA para los pacientes normotérmicos. Los esfuerzos también deben centrarse en mantener la normoxia durante la reanimación.El paro cardíaco hipotérmico a menudo es refractario a la desfibrilación y la adrenalina. Los intentos de desfibrilación han sido exitosos en pacientes con una temperatura central > 24 °C, sin embargo, el ROSC tiende a ser inestable con una temperatura más baja.168 El corazón hipotérmico puede no responder a los medicamentos cardioactivos, al intento de estimulación eléctrica y a la desfibrilación. Si la fibrilación ventricular o la taquicardia ventricular sin pulso persisten después de tres choques, es razonable retrasar los nuevos intentos hasta que la temperatura central sea > 30 °C.El metabolismo de los medicamentos se ralentiza, lo que lleva a concentraciones plasmáticas potencialmente tóxicas, por lo tanto, los medicamentos deben administrarse con precaución. La evidencia de la eficacia de la medicación en la hipotermia grave es limitada y se basa principalmente en estudios con animales. En el paro cardíaco hipotérmico grave, la eficacia de la amiodarona se reduce.169 La adrenalina puede ser efectiva para aumentar la presión de perfusión coronaria, pero no la supervivencia.170,171 La adrenalina puede inducir lesión miocárdica y deterioro de la recuperación neurológica; es razonable retener la adrenalina y otros medicamentos de RCP hasta que el paciente haya sido calentado a una temperatura central ≥ 30 °C. Si el acceso al soporte vital extracorpóreo se retrasa, ya que la duración más corta de la RCP podría estar asociada con un mejor resultado, puede ser razonable administrar 1 mg de adrenalina incluso a una temperatura central más baja en un intento de lograr el ROSC.172 Una vez que se hayan alcanzado los 30 °C, los intervalos entre las dosis del medicamento deben duplicarse en comparación con los de la normotermia (es decir, adrenalina cada 6-10 minutos). Una vez que se logre la normotermia (≥35 °C), utilice protocolos de medicamentos estándar.Si es posible, transfiera a los pacientes hipotérmicos arrestados (o aquellos en riesgo de ser arrestados), directamente a un hospital capaz de proporcionar soporte vital extracorpóreo. Si se requiere un transporte prolongado o el terreno es difícil, se sugiere la RCP mecánica. En pacientes detenidos hipotérmicos con una temperatura corporal < 28 °C, se puede usar la RCP retrasada cuando la RCP es demasiado peligrosa, y la RCP intermitente se puede usar cuando la RCP continua no es posible, por ejemplo, debido a un rescate técnicamente difícil (Fig. 13).173
Establecer soporte vital extracorpóreo solo en paro cardíaco o pacientes en deterioro (por ejemplo, disminución de la presión arterial, aumento de la acidosis). El ECLS primario se puede considerar en pacientes con ETCO2 < 10 mmHg (1,3 kPa) o una presión arterial sistólica ≤ 60 mmHg.174 Un paro cardíaco no testigo con asistolia como primer ritmo no es una contraindicación para el recalentamiento de ECLS.152 El recalentamiento debe realizarse preferiblemente con VA-ECMO en lugar de bypass cardiopulmonar.175,176 Si el ECLS no está disponible dentro de las 6 h, se puede utilizar el recalentamiento de soporte vital no extracorpóreo.177,178El pronóstico hospitalario del recalentamiento exitoso debe basarse en la puntuación HOPE.158,160 La puntuación 5A es una herramienta de detección para predecir la mortalidad hospitalaria entre pacientes de edad avanzada con hipotermia accidental con o sin paro cardíaco, lo que también puede guiar las opciones de tratamiento.179,180 En pacientes hipotérmicos detenidos, los criterios para el recalentamiento de ECLS no deben basarse en las pautas para el paro cardíaco normotérmico.181 Esto puede resultar en que se retenga un tratamiento potencialmente vital en pacientes con un posible buen resultado neurológico.176Los servicios médicos de emergencia y los hospitales deben instalar protocolos estructurados para mejorar el triaje, el transporte y el tratamiento prehospitalarios, así como el manejo hospitalario de los pacientes hipotérmicos.
Rescate de avalanchas
Las posibilidades de sobrevivir al entierro de avalanchas están mejorando constantemente, debido a los esfuerzos de colaboración para mejorar la búsqueda y rescate de avalanchas, y las intervenciones médicas posteriores.182 La mayoría de las víctimas de avalanchas mueren por asfixia, menos de trauma o hipotermia. En los casos de paro cardíaco no testigo que se presenta en asístole, las víctimas de avalanchas tienen pocas posibilidades de supervivencia, incluso si se siguen las pautas.183-185Varios factores mejoran la probabilidad de un buen resultado del entierro en avalanchas. Estos incluyen el entierro no crítico (es decir, la cabeza y el pecho fuera de la nieve), el entierro superficial, el entierro por un corto tiempo, el entierro durante el día, la presencia de una bolsa de aire (es decir, las vías respiratorias abiertas además de cualquier espacio en la nieve frente a la nariz y la boca), la recuperación antes del paro cardíaco, el paro cardíaco presenciado y el ROSC en los primeros minutos de la RCP.182-184,186,187 La Comisión Internacional de Medicina de Emergencia de Montaña realizó una revisión de alcance y publicó pautas para el manejo de las víctimas enterradas en avalanchas (Fig. 14).188
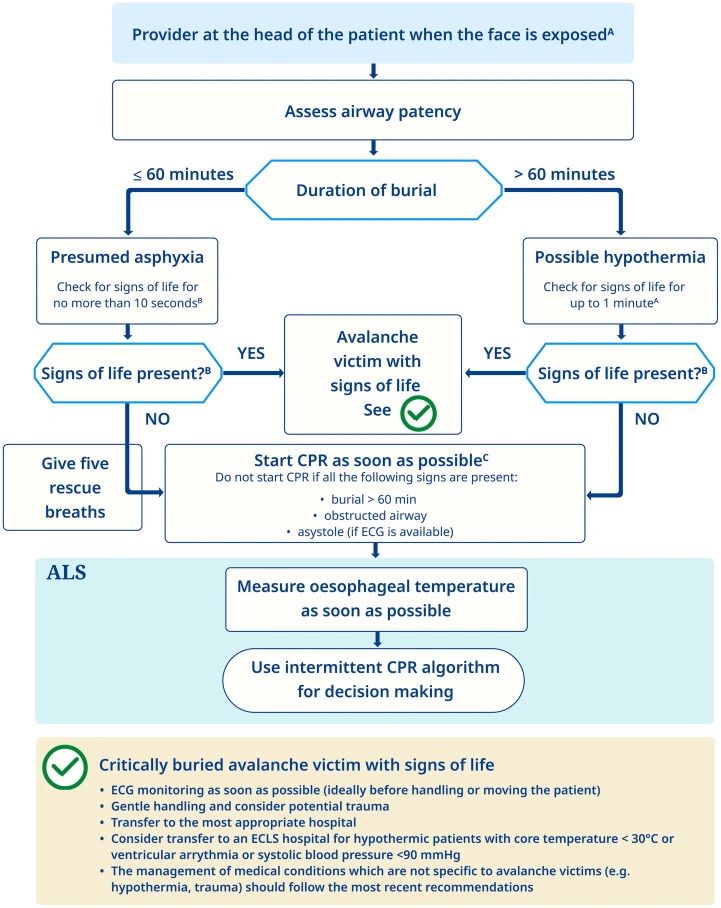
El algoritmo AvaLife debe usarse en múltiples escenarios de entierro con muy pocos rescatistas en el lugar. En esta situación de triaje, AvaLife permite la identificación de los i) sujetos enterrados que deben ser excavados primero (corte < 1,5 m de profundidad de entierro) y ii) que deben ser resucitados y por cuánto tiempo.189 AvaLife se ha desarrollado específicamente para el proveedor de BLS.La calidad de la RCP puede verse comprometida por varios factores, incluyendo el espacio confinado del lugar de enterramiento, las compresiones torácicas en la nieve, la hipoxia hipobárica en las montañas que conduce a un agotamiento más rápido de los rescatistas y la larga y difícil extricación y transporte de las víctimas. Los dispositivos mecánicos de compresión torácica pueden ser útiles en rescates técnicamente difíciles y prolongados.190–192
Trombosis
Embolia pulmonar
El paro cardíaco por embolia pulmonar aguda (EP) es la presentación clínica más grave del tromboembolismo venoso, en la mayoría de los casos que se origina en una trombosis venosa profunda (TVP).193 La incidencia reportada de paro cardíaco causada por EP es del 2 al 7 % de todos los OHCA,194,195 y del 5-6 % de todos los paros cardíacos hospitalarios,75,196, pero es probable que se subestime. La supervivencia general es baja, incluso si se utiliza un tratamiento invasivo o ECPR.195,197,198 Los tratamientos específicos para el paro cardíaco resultante de la EP incluyen la administración de fibrinolíticos, embolectomía quirúrgica y trombectomía mecánica percutánea.La revisión sistemática de ILCOR de 2020 exploró la influencia de tratamientos específicos (por ejemplo, fibrinolíticos o cualquier otro) que producen resultados favorables.199 La declaración resumida de ILCOR de 2019 revisó el uso de ECPR para el paro cardíaco en adultos,200 mientras que la declaración resumida de ILCOR de 2022 actualizó la evidencia sobre la sensibilidad y especificidad de POCUS para estados fisiopatológicos específicos, incluida la EP, y revisó cuatro pequeños estudios observacionales adicionales sobre el paro cardíaco por EP que se publicaron desde la revisión anterior. No se encontró evidencia adicional para cambiar el manejo.201 Se identificó evidencia adicional de la guía de la Sociedad Europea de Cardiología (ESC) sobre la embolia pulmonar.193Estas directrices ESC definen la «embolia pulmonar confirmada» como una probabilidad de embolia pulmonar lo suficientemente alta como para indicar la necesidad de un tratamiento específico.193 El historial clínico, la evaluación, la capnografía y la ecocardiografía (si está disponible) pueden ayudar en el diagnóstico de la embolia pulmonar aguda durante la RCP. El paro cardíaco se presenta comúnmente como PEA.197 Lecturas bajas constantes de ETCO2 (por debajo de 1,7 kPa (13 mmHg)) mientras se realizan compresiones torácicas de alta calidad pueden apoyar un diagnóstico de embolia pulmonar, aunque es un signo inespecífico. 202,203 Si se puede obtener un ECG de 12 derivaciones antes del paro cardíaco, los cambios indicativos de la tensión ventricular derecha pueden ser útiles para la toma de decisiones.Los síntomas comunes que preceden al paro cardíaco se describen en la Tabla 6.
Síntomas previos al paro cardíacoI
nicio repentino de disneaDolor pleurítico o subesternal en el pecho Tos Hemoptisis Síncope (de otro modo, colapsos inexplicables y/o repetidos)
Signos de TVP (hinchazón unilateral de las extremidades inferiores)
Signos de tensión ventricular derecha en el ECG de 12 derivaciones (si se obtiene antes del paro cardíaco)
•Inversión de ondas T en cables V1–V4•Patrón QR en V1•
Patrón S1 Q3 T3 (es decir, una onda S prominente en el cable I, una onda Q y una onda T invertida en el cable III)
•Bloque de rama de haz derecho incompleto o completo
Evaluación durante la reanimación
Sexo biológico femenino
Edad más baja EMS presenció un paro cardíaco PEA como primer ritmo observado Lecturas bajas de ETCO2 durante la RCP de alta calidad (<1,7 kPa/13 mmHg) Presencia de dilatación del corazón derecho con mal llenado del corazón izquierdo, signo D (enderezar el tabique interventricular) y/o trombos intracardíacos (POCUS intra-paro)
La embolia pulmonar aguda puede causar sobrecarga de presión ventricular derecha y disfunción, POCUS podría ser útil para la detección, (Tabla 6). pero ningún parámetro ecocardiográfico individual proporciona información rápida y confiable sobre el tamaño o la función del ventrículo derecho. Los signos de sobrecarga o disfunción ventricular derecha también pueden ser causados por otras enfermedades cardíacas o pulmonares.204
Tratamiento inicial (Fig. 15)
Todos los pacientes con una aparición repentina de disnea progresiva, especialmente en pacientes sin enfermedad cardíaca o pulmonar preexistente, son sospechosos de la embolia pulmonar. La hipoxemia generalmente se revierte con la administración de oxígeno, mientras que, en algunos pacientes, la corrección de la hipoxemia no será posible sin reperfusión pulmonar simultánea.193
Se sospecha que la embolia pulmonar de alto riesgo con shock o hipotensión arterial persistente y es inmediatamente mortal. Deje a los pacientes hipotensos acostados si la respiración lo permite, para prevenir una mayor progresión de la hipotensión y el paro cardíaco. La insuficiencia ventricular derecha aguda es la principal causa de muerte en pacientes con embolia pulmonar de alto riesgo. La expansión agresiva del volumen no es beneficiosa e incluso puede empeorar la función ventricular derecha. Sin embargo, la carga de volumen cautelosa (≤ 500 ml durante 15-30 min) puede aumentar el gasto cardíaco, y el uso de vasopresores y/o inotrópicos es frecuentemente beneficioso.193La anticoagulación intravenosa debe iniciarse mientras se esperan los resultados de las pruebas de diagnóstico. Se recomienda heparina no fraccionada para pacientes con shock e hipotensión, y para quienes se considera la reperfusión primaria. El tratamiento trombolítico de la embolia pulmonar aguda restaura la perfusión pulmonar más rápidamente que la anticoagulación con heparina sola.206
Modificaciones a la ELA
Fibrinólisis
Si la embolia pulmonar es la causa sospechosa de paro cardíaco, se deben administrar medicamentos fibrinolíticos, según la evidencia de un ILCOR CoSTR.201 No hay evidencia suficiente para recomendar una estrategia óptima de medicamentos y dosificación para la fibrinólisis durante la RCP. El ROSC y la supervivencia se observaron después del activador de plasminógeno de tipo de tejido recombinante (alteplasa, bolo 50 mg IV con o sin 50 mg adicionales después de 30 minutos, o 0,6-1,0 mg/kg IV – máx. 100 mg).197,207,208 Cuando se han administrado medicamentos trombolíticos, continúe con la RCP durante al menos 60-90 min.195,209,210 Según la opinión de expertos, se debe considerar la trombólisis o la embolectomía quirúrgica para las mujeres embarazadas con embolia pulmonar de alto riesgo y EP que causan paro cardíaco.193
Embolectomía quirúrgica o trombectomía mecánica percutánea
Se ha informado de embolectomía quirúrgica y trombectomía mecánica percutánea exitosa en pacientes con paro cardíaco y se recomienda si la EP es la causa conocida de paro cardíaco, y las habilidades especializadas están disponibles.211–213 Las decisiones de tratamiento deben ser tomadas por un equipo interdisciplinario altamente experimentado, que involucre a un cirujano torácico o cardiólogo intervencionista.193,214
RCP extracorpórea
Algunos estudios observacionales sugieren que el uso de la ECPR si el paro cardíaco está asociado con una embolia pulmonar198,215 La ECPR mantiene la circulación y el intercambio de gases. El tiempo de la CPR se correlaciona con el resultado neurológico.216 Considere la ECPR como una terapia de rescate para pacientes seleccionados con paro cardíaco cuando la RCP convencional está fallando en entornos en los que se puede implementar.201 Se recomienda que se establezca un flujo adecuado de ECPR dentro de los 60 minutos posteriores al inicio del paro cardíaco. 217 Los resultados neurológicos favorables en pacientes con embolia pulmonar sometidos a ECPR son inferiores a los resultados relacionados con otra etiología.198,218 A pesar de la tasa de mortalidad extremadamente alta de pacientes con paro cardíaco refractario a la ELA estándar, la ECPR también es una opción para aumentar el grupo de donantes de órganos.198
Trombosis coronaria
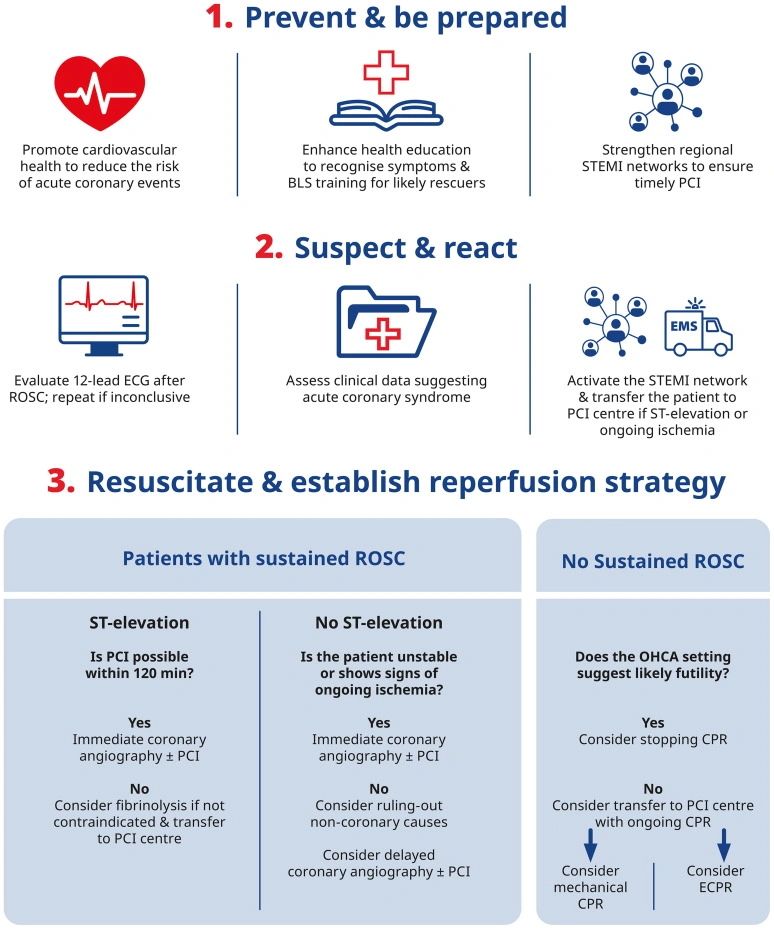
La enfermedad de la arteria coronaria (CAD) sigue siendo la principal causa de OHCA en adultos, ya sea debido a arritmias ventriculares provocadas por isquemia miocárdica aguda, o a las que surgen del sustrato arritmitógeno fibroso en pacientes con infarto de miocardio previo.219,220 Si bien la prevalencia de CAD aumenta con la edad, también es la causa más común de muerte cardíaca en adultos de 35 a 50 años.221,222Una revisión sistemática reciente y un metanálisis informaron una CAD significativa en el 75 % de los casos de OHCA,223 que oscilaron entre el 88 % en pacientes con ritmo inicial y elevación del ST en el ECG, hasta el 54 % en casos no conmocionables sin elevación del ST. Las lesiones culpables se identificaron en casi el 60 %, más a menudo en pacientes con ritmo de choque y elevación del segmento ST, mientras que la oclusión coronaria aguda se encontró en alrededor del 40 %, con una mayor prevalencia en pacientes con elevación del segmento ST. Entre los que tenían un paro cardíaco refractario, el 75 % tenía una CAD significativa y el 70 % tenía una lesión culpable, que a menudo involucraba la arteria coronaria principal izquierda.Las estrategias de prevención de la CAD como causa de OHCA deben incluir la promoción de estilos de vida saludables en individuos asintomáticos, así como abordar los factores de riesgo modificables de la aterosclerosis en pacientes con enfermedad conocida, de manera más efectiva a través de la rehabilitación cardíaca.224,225La educación sanitaria debe apuntar a la reducción del tiempo desde el inicio de los síntomas (es decir, dolor en el pecho) hasta la búsqueda de ayuda médica, con el fin de permitir el diagnóstico y el tratamiento tempranos. Las técnicas de cambio de comportamiento (planificación de acciones, información sobre consecuencias para la salud, signos y síntomas e instrucciones sobre qué hacer) podrían ser útiles para este propósito en particular.226Un ILCOR CoSTR actualizado de 2022 concluyó que la capacitación de BLS mejoró constantemente las habilidades, el conocimiento de BLS y aumentó la confianza para realizar la RCP. Por lo tanto, se recomienda la capacitación de BLS para posibles espectadores de poblaciones de alto riesgo y debe ser promovida activamente por los profesionales de la salud.201Junto con las iniciativas de sensibilización pública, los sistemas de salud deben establecer redes regionales de IECST para garantizar un acceso igual y oportuno a la intervención coronaria percutánea (ICP).225 Una reciente revisión sistemática y un metanálisis encontró que tales redes pueden reducir la mortalidad por IEMC en un 35 % y la mortalidad a largo plazo en un 27 %.227 La integración del sistema de transporte de emergencia fue un factor crítico para el éxito.
Detectar características que sugieren trombosis coronaria y activar la red STEMI
Se debe obtener y evaluar un electrocardiograma (ECG) de 12 derivaciones después de ROSC para identificar posibles características isquémicas. Los ECG adicionales pueden ayudar a la toma de decisiones, ya que la desfibrilación y el tiempo transcurrido desde el ROSC hasta la adquisición del ECG pueden afectar los hallazgos, con un porcentaje más alto de falsos positivos para STEMI si el ECG se realiza ≤ 8 minutos desde el ROSC.228 La elevación del segmento ST sigue siendo el signo más sensible y específico de la oclusión de la arteria coronaria; sin embargo, su ausencia no excluye por completo la condición.229 Otros patrones de ECG, como el bloqueo de la rama del haz o la depresión ST difusa con elevación simultánea del segmento ST en aVR y/o V1, pueden sugerir oclusión coronaria y deben considerarse si el contexto clínico es compatible.225 Además, las afecciones no cardíacas, como la hemorragia subaracnoidea, también pueden Causa cambios en el ST,230 destacando la importancia de la correlación clínica.Se recomienda un enfoque integral que integre los hallazgos del ECG y la información clínica que sugiere una posible causa coronaria, como un historial de CAD, dolor en el pecho antes de la detención o un ritmo inicial de shock, 231. Una vez establecida la sospecha clínica, la red STEMI debe activarse rápidamente para garantizar la transferencia temprana a un centro con capacidad PCI.
Reanimar de acuerdo con el algoritmo de ELA y establecer una estrategia de reperfusión
Pacientes con ROSC y elevación ST
La reanimación de la OHCA debe seguir el protocolo estándar de ELA (ver capítulo de ELA). Los pacientes conscientes con elevación persistente del segmento ST (o equivalente) después de ROSC deben someterse a una angiografía coronaria inmediata y una ICP dentro de los 120 minutos posteriores al diagnóstico, según el manejo estándar de IAMCEST. Si se esperan retrasos significativos, se puede considerar la fibrinólisis prehospitalaria a menos que la RCP haya sido prolongada o traumática o haya otras contraindicaciones, seguida de un traslado inmediato al centro de ICP. 225 pacientes con coma con elevación del ST después de ROSC tienen un pronóstico significativamente peor, y ningún ECA ha comparado directamente la angiografía temprana con la tardía en este grupo. Sin embargo, dado que la angiografía temprana es el estándar de atención para el IAMCEST y no hay evidencia que sugiera lo contrario, tanto el ILCOR 232 como la Sociedad Europea de Cardiología225 recomiendan el mismo enfoque para estos pacientes.La terapia farmacológica debe alinearse con los protocolos de STEMI para pacientes no detenidos.225 En pacientes dirigidos a una estrategia primaria de ICP, se recomienda aspirina y se puede considerar la administración temprana de un inhibidor de P2Y12 (ticagrelor o prasugrel sobre clopidogrel, o cangrelor IV si no es posible la ingesta oral). La heparina no fraccionada (IV) es el anticoagulante preferido, con enoxaparina (SC) o bivalirudina (IV) como alternativas.
Pacientes con ROSC y sin elevación del ST
Mientras que los estudios observacionales previos sugirieron un beneficio potencial de la angiografía coronaria temprana en pacientes reanimados sin elevación del segmento ST en el ECG,233,234 ECA recientes no lo han confirmado. Una revisión sistemática y metanálisis ILCOR de 2021235 compararon la angiografía coronaria temprana (de rutina (2–6 h) frente a la tardía (dentro de las 24 h) en pacientes adultos inconscientes con ROSC después de la OHCA. Esto incluyó datos de la angiografía coronaria directa o subaguda en el ensayo de paro cardíaco fuera del hospital-DISCO (n = 79),236 Angiografía coronaria después del ensayo de paro cardíaco-COACT (n = 552)237 y ensayo clínico piloto aleatorio de angiografía coronaria temprana-PEARL (n = 99)238 – este último con poca potencia. No se encontró supervivencia o beneficio neurológico para la angiografía temprana frente a tardía en pacientes sin elevación del ST. En 2022, un ILCOR CoSTR232 actualizado agregó los resultados de la angiografía después de un paro cardíaco fuera del hospital sin ensayo ST-Segment Elevation-TOMAHAWK (n = 554),239 que tampoco encontró ninguna ventaja de un enfoque temprano de rutina. En consecuencia, el Grupo de Trabajo consideró razonable tanto la angiografía temprana como la retardada en pacientes sin elevación del segmento ST después de ROSC (recomendación débil, evidencia de baja certeza).232 Dos últimos ECA, Angiograma coronario de emergencia frente a retardado en sobrevivientes de paro cardíaco fuera del hospital-EMERGE (n = 279)240 y angiografía coronaria en paro cardíaco fuera del hospital. Los pacientes sin elevación del segmento ST-COUPE (n = 66)241 han reforzado estos hallazgos, a pesar de las variaciones en los protocolos del estudio y las definiciones de resultados, así como el poder estadístico limitado.Es importante destacar que los pacientes con shock, inestabilidad eléctrica o signos de isquemia en curso fueron excluidos o se les permitió cruzar al brazo de emergencia. Por lo tanto, la evidencia actual no respalda la angiografía de rutina temprana sobre tardía en pacientes estables sin elevación del ST en el ECG post-ROSC. Sin embargo, las decisiones individuales deben considerar el estado hemodinámico del paciente y los signos de isquemia en curso. Además, se recomienda descartar causas no coronarias si el contexto clínico sugiere una posible etiología alternativa para el arresto.El tratamiento farmacológico generalmente debe seguir las recomendaciones para el síndrome coronario agudo sin elevación del segmento ST si se sospecha.225 Se recomienda la aspirina, pero se desaconseja el uso temprano de rutina de inhibidores de P2Y12 si se planea una angiografía temprana. La heparina no fraccionada (IV) y el fondaparinux (SC) son los anticoagulantes preferidos para las estrategias de angiografía temprana y tardía, respectivamente. Sin embargo, si hay preocupaciones sobre otras causas no coronarias para el arresto, la retención de las terapias antiplaquetarias y anticoagulantes hasta que se evalúe una evaluación adicional.
Pacientes sin ROSC sostenido
La RCP mecánica y, en última instancia, la ECPR podrían ser la única opción terapéutica para la OHCA refractaria. El primero no ha demostrado una superioridad consistente sobre la RCP manual, pero puede facilitar la entrega de compresión torácica de alta calidad durante el transporte o durante la la angiografía coronaria.242 Los estudios que abordan la RCP en este entorno han reportado resultados contradictorios. Una revisión sistemática actualizada de ILCOR comparó la ECPR con la RCP manual o mecánica para la OHCA refractaria, evaluando la supervivencia y los resultados neurológicos.8,243 Esto incluyó dos ECA de un solo centro: el ensayo ARREST (n = 30) terminó temprano debido a la superioridad en el brazo de ECPR para el resultado primario (supervivencia al alta hospitalaria). La interpretación de los estudios incluidos fue difícil debido a los diferentes diseños de estudio y los hallazgos inconsistentes.244,245 Un ECA multicéntrico no encontró ninguna diferencia en la supervivencia a 30 días con resultados neurológicos favorables.246 Dados estos hallazgos no concluyentes, pero considerando el posible equilibrio riesgo-beneficio en este escenario de mal pronóstico, la ECPR puede considerarse como una terapia de rescate para pacientes seleccionados de OHCA cuando la RCP convencional no logra el ROSC, siempre que se pueda implementar.243
Agentes tóxicos
La intoxicación es una de las ocho causas reversibles de paro cardíaco. Por lo tanto, todos los pacientes con paro cardíaco deben ser examinados para detectar signos de intoxicación, especialmente en casos sospechosos, paros cardíacos inesperados o en casos con más de una víctima. Si es probable que se produzca una intoxicación, los equipos de reanimación deben evitar la contaminación poniendo primero el equipo de protección personal (EPP) adecuado. El contacto directo con la piel o la ventilación boca a boca podrían transmitir agentes tóxicos y, por lo tanto, deben evitarse (ver Fig. 7). La estrategia terapéutica de la intoxicación consiste en los tres pilares:•Descontaminación•Eliminación mejorada•Administración de antídotosLas bases de datos en línea útiles sobre centros de veneno y toxinas se pueden encontrar en los códigos QR 2 y 3). La temperatura del paciente debe medirse porque la hipo o hipertermia puede ocurrir durante una sobredosis de medicamentos, como se mencionó anteriormente. Las directrices del ERC de 2021 proporcionan una visión general detallada sobre la intoxicación.99 Estas recomendaciones actualizadas se basan en evidencia científica reciente, revisiones sistemáticas y consenso de expertos. Un subcapítulo separado aborda la toxicidad sistémica anestésica local.
ntoxicación con opioides
Una revisión sistemática de ILCOR encontró resultados heterogéneos sobre el beneficio de las terapias avanzadas de soporte vital específicas de opioides para el paro cardíaco.247 La evidencia existente no es suficiente para recomendar la administración de un antagonista de opioides (por ejemplo, naloxona) para el paro cardíaco causado por envenenamiento por opioides.
Intoxicación con glucósido cardíaco
Una revisión narrativa sobre el tratamiento de pacientes con inestabilidad hemodinámica causada por intoxicación por glucósidos cardíacos encontró una mejora del estado hemodinámico y la supervivencia después de la administración de fragmentos de digoxina inmune-Fab. Se observaron resultados favorables en pacientes que recibieron magnesio, cardioversión o ritmo cardíaco.248
ECPR
La CPRC parece estar asociada con un aumento de la supervivencia en pacientes intoxicados en shock cardiogénico refractario o paro cardíaco.249
Paro cardíaco traumático
El paro cardíaco traumático está asociado con una mortalidad muy alta y se informa de un buen resultado neurológico en menos del 50 % de los que sobreviven. La respuesta al paro cardíaco traumático es de tiempo crítico y el éxito depende de una cadena de supervivencia bien establecida, incluida la atención prehospitalaria avanzada y especializada en el centro de trauma. Los esfuerzos de reanimación inmediata en el paro cardíaco traumático se centran en el tratamiento simultáneo de causas reversibles, que tiene prioridad sobre las compresiones torácicas. La evidencia se basa en nueve revisiones sistemáticas y actualizaciones de evidencia y consenso del grupo de expertos.250-258En Europa, el paro cardíaco traumático representa el 4 % de todos los paros cardíacos que ocurren en el entorno prehospitalario.259 Los datos del registro para la supervivencia oscilan entre el 0 %260 y el 37 %.261 Una reciente revisión sistemática255 del paro cardíaco traumático identificó 36 estudios y un total de 51.722 pacientes, que reportan una tasa de mortalidad general del 96,2 %, con el 43,5 % de los sobrevivientes que lograron un resultado neurológico favorable. La presencia de un médico en la escena prehospitalaria se asoció con resultados mejorados (6,1 % frente a 2,4 % de supervivencia y 57,0 % frente a 38,0 % de resultados neurológicos favorables, con o sin médico respectivamente). Otra revisión sistemática confirmó estos hallazgos.253
Los factores relevantes para el pronóstico se enumeran en la Tabla 7.
-+ . Edad, Cirugía de emergencia, Mujer, Atención al centro de trauma mayor, Aumento de la ISS, Ritmo de ECG, impactante Lesión en la cabeza. pupilas no reactivos, Choque en la admisión, Actividad respiratoria, Necesidad de transfusión de sangre Movimientos espontáneos de los ojos o de las extremidades, RCP en el departamento de emergencias. Ritmo de ECG organizadoniños, Duración más corta de la RCP Tiempo prehospitalario reducido Lesión torácica penetrante Arresto de testigos Movimiento cardíaco en la ecografía.
etención de la reanimación
El Colegio Americano de Cirujanos y la Asociación Nacional de Médicos de EMS recomiendan retener la reanimación en situaciones en las que la muerte es inevitable o establecida y en pacientes con trauma que presentan apnea, falta de pulso y sin actividad de ECG organizada.271 Sin embargo, se han informado de sobrevivientes neurológicamente intactos que inicialmente se presentan en este estado. 272 El ERC basado en el consenso de expertos recomienda el siguiente enfoque:Considere la posibilidad de retener la reanimación en un paro cardíaco traumático en cualquiera de las siguientes condiciones:•No hay señales de vida en los 15 minutos anteriores.•Trauma masivo incompatible con la supervivencia (por ejemplo, decapitación, destrucción cardíaca extensa, lesión masiva en la cabeza con pérdida de tejido cerebral).Sugerimos la terminación de los esfuerzos de reanimación si hay:•No hay ROSC dentro de los 20 minutos posteriores a que se hayan abordado las causas reversibles.•No hay actividad cardíaca ecográfica detectable en PEA 20 minutos después de que se hayan abordado las causas reversibles.
Muertes evitables
Para un diagnóstico de TCA, debe haber signos plausibles de lesión traumática o, al menos, un mecanismo de lesión consistente con el trauma. En ausencia de un mecanismo identificable o signos visibles de lesión, se debe seguir el algoritmo de ELA estándar. El uso de ultrasonido apoya los hallazgos en este contexto, ayudando a diferenciar el peri-arresto de la TCA, identificando causas reversibles y guiando los esfuerzos de reanimación en consecuencia.273Una proporción considerable de las muertes relacionadas con el trauma puede atribuirse a errores de manejo. En una población alemana urbana, la prevalencia de muertes prehospitalarias potencialmente prevenibles por traumatismo se informó del 15,1 %,274, mientras que en una población urbana de los Estados Unidos, esta cifra fue más alta en un 29 %.275 En Australia, se encontró que la tasa de muertes por traumatismo potencialmente prevenibles era del 20 %.276 A lo largo de estos estudios, la exsanguinación se identificó como una de las principales causas de muerte prevenible. Teniendo en cuenta estos datos, el ERC recomienda la participación en un programa acreditado de capacitación en manejo de traumas para aquellos involucrados en el cuidado de pacientes con trauma. Idealmente, dicho formato de formación refleja el enfoque estándar del equipo proporcionado en los sistemas europeos.277Las causas reversibles asociadas con la TCA son hemorragia no controlada (48 %); neumotórax por tensión (13 %); asfixia (13 %); y taponamiento cardíaco (10 %). Los ritmos de presentación encontrados en el paro cardíaco traumático suelen ser PEA o asistole, dependiendo del intervalo de tiempo entre el paro circulatorio y la primera grabación de ECG; PEA (66 %); asístole (30 %); VF (4 %).278 Los mecanismos fisiopatológicos clave que conducen al paro cardíaco traumático se enumeran en la Tabla 8:
medida que estos mecanismos progresan más allá de un umbral crítico, se produce un fallo circulatorio irreversible:•Bradicardia progresiva e hipotensión (causada por hipoxia y acidosis graves)•PEA con actividad cardíaca mínima en la ecografía (Pseudo-PEA) se refiere a un estado en el que el corazón exhibe una actividad contráctil débil en la ecografía, pero no logra generar un pulso o circulación efectivos.266•EA sin actividad cardíaca detectable en el ultrasonido. La mortalidad de esta condición se acerca al 100 %.•Asístole → La etapa final del paro cardíaco, sin actividad eléctrica o mecánica.
Eficacia de las compresiones torácicas
En casos de paro cardíaco debido a hipovolemia, taponamiento cardíaco o neumotórax por tensión, la efectividad de las compresiones torácicas es incierta. Su impacto probablemente depende del llenado ventricular, que se ve comprometido en estas condiciones, y los estados inperi-paro (pseudo-PEA), las compresiones torácicas pueden incluso reducir el gasto cardíaco restante al disminuir aún más el retorno venoso.279-281 Por lo tanto, las compresiones torácicas no deben retrasar el tratamiento inmediato de las causas reversibles.Después de la toracotomía de reanimación, las compresiones cardíacas abiertas podrían ser beneficiosas. Los pacientes que sufren un paro cardíaco traumático dentro de las primeras seis horas de ingreso hospitalario pueden beneficiarse de la compresión cardíaca abierta en lugar de las compresiones torácicas cerradas; en un ensayo retrospectivo, las compresiones cardíacas abiertas en el paro cardíaco traumático se asociaron con una mayor supervivencia a largo plazo tanto en el trauma penetrante como en el contundente. Sin embargo, el estudio no aborda el manejo de causas reversibles.282Los proveedores sin capacitación para manejar causas reversibles deben seguir el algoritmo estándar de ELA y priorizar el transporte rápido bajo ELA o BLS, dependiendo de la capacidad del sistema. Aquellos con la experiencia necesaria deben tomar decisiones caso por caso en función de los recursos disponibles, las causas probablemente reversibles y las directrices regionales.
El papel de los inotrópicos y los vasopresores
Aunque la adrenalina puede aumentar las tasas de ROSC con paro cardíaco médico,283 el papel de los inotrópicos y vasopresores en el paro cardíaco traumático (TCA) no está claro.284 Pueden servir como un puente temporal hasta que se aborden las causas reversibles. Su uso también se puede considerar en shock en etapa tardía con disfunción cardíaca o estados de shock mixto, como traumatismos con un componente neurogénico. El objetivo principal en el paro cardíaco traumático es identificar y tratar cualquier causa reversible que deba ser preferible a la terapia inotrópica/vasopresora.
Atención prehospitalaria
El algoritmo TCA (Fig. 8) se aplica no solo a los pacientes en paro cardíaco traumático, sino también a los pacientes con trauma peri-arresto que presentan signos de colapso circulatorio inminente. En ambos escenarios, la respuesta debe ser inmediata, específica y adaptada a las capacidades del sistema prehospitalario. La elección entre una estrategia de «quedarse y tratar» frente a «scoop and run» o «tratar a medida que se va» depende menos de la geografía y más del conjunto de habilidades disponibles, el equipo y la infraestructura del sistema. En sistemas altamente capacitados con capacidades extendidas, las intervenciones que salvan vidas pueden ser factibles en la escena. En otros, la transferencia inmediata puede ser la mejor oportunidad de supervivencia, siempre que se garantice el control básico de la hemorragia y la oxigenación durante el transporte. Independientemente de la configuración del sistema, se debe evitar el tiempo prehospitalario prolongado.273 La prealerta temprana del Centro de Trauma Mayor (MTC) es esencial. En casos de hemorragia en curso o compromiso fisiológico grave, el paciente debe ser declarado «Código Rojo» (o equivalente), lo que permite al hospital activar el protocolo de transfusión masiva, movilizar al equipo de trauma y garantizar el acceso inmediato a la atención quirúrgica a su llegada.Las directrices de práctica recientemente publicadas del Real Colegio de Cirujanos de Edimburgo sobre el paro cardíaco traumático proporcionan una visión general completa de la gestión prehospitalaria.285
Atención hospitalaria
El tratamiento exitoso del paro cardíaco traumático requiere un enfoque altamente coordinado y basado en el equipo, donde todas las intervenciones que salvan la vida se llevan a cabo en paralelo en lugar de secuencialmente, según las prioridades clínicas dictadas por la presentación del paciente. La atención se centra en la rápida identificación y el tratamiento de todas las causas potencialmente reversibles para maximizar las posibilidades de supervivencia. Un estudio observacional prospectivo en pacientes con lesiones exsanguinantes y presión arterial sistólica < 90 mmHg mostró una menor mortalidad a 30 días (17,5 % frente a 72,0 %, p < 0,001) al priorizar la circulación (enfoque CAB) sobre la intubación traqueal (aproximación ABC), lo que permite el control de la hemorragia de reanimación antes de la ventilación.286 La figura 8 ilustra el algoritmo cardíaco traumático (peri-paro), que se basa en el algoritmo universal de ELA, pero integra modificaciones específicas del trauma para adaptarse a los desafíos únicos del manejo del paro cardíaco traumático. Un enfoque de equipo multidisciplinario, que incluya cirujanos de trauma, médicos de emergencia, anestesistas, radiólogos, intensivistas y personal de enfermería, es esencial para garantizar que cada intervención crítica se inicie sin demora, de acuerdo con las necesidades inmediatas del paciente.
Tratamiento de las causas reversibles del paro cardíaco traumático
Hipovolemia
El tratamiento de la hipovolemia grave tiene varios componentes. El principio principal es lograr una hemostasia inmediata. El control temporal de la hemorragia puede salvar vidas.273 La hemorragia externa compresible se puede tratar con elevación (de una extremidad sangrante), presión directa o indirecta, apósitos de presión, torniquetes y agentes hemostáticos tópicos.273,287 La hemorragia no compresible es más difícil de abordar y las férulas (férula pélvica), los productos sanguíneos, los fluidos intravenosos y el ácido tranexámico se pueden usar durante la transferencia del paciente para el control quirúrgico de la hemorragia.288Se recomienda la oclusión aórtica inmediata como medida de último recurso en pacientes con hemorragia infradiafragmática del torso exanguínea e incontrolable. Esto se puede lograr a través de la toracotomía de reanimación y sujeción cruzada (o compresión manual) de la aorta descendente o oclusión de balón endovascular de reanimación de la aorta (REBOA). No hay evidencia de que una técnica sea superior a la otra.289 Ambas son intervenciones altamente especializadas, experiencia y equipo apropiados. Un reciente estudio REBOA del Reino Unido290 en shock traumático reveló un posible aumento de la mortalidad. El ERC no recomienda el uso de REBOA fuera de los ensayos clínicos.En el paro cardíaco traumático hipovolémico, es obligatorio restaurar inmediatamente el volumen sanguíneo circulante con productos sanguíneos. La transfusión prehospitalaria de plasma fresco y glóbulos rojos concentrados puede mejorar la supervivencia, especialmente en casos con tiempo prehospitalario prolongado.291,292 La evidencia reciente sugiere un beneficio adicional de la transfusión de sangre completa.258,293
Hipoxia
En el paro cardíaco traumático, la hipoxemia puede ser causada por obstrucción de las vías respiratorias, asfixia traumática o apnea cerebral de impacto.294 La apnea cerebral de impacto es una causa subestimada de morbilidad y mortalidad en el trauma, pero no necesariamente asociada con una lesión cerebral no supervivible.295 Los datos de la base de datos de la Red Nacional de Auditoría e Investigación de Trauma en el Reino Unido informaron una tasa de supervivencia del 15 % con un resultado favorable del 90 % entre los pacientes con paro cardíaco traumático con apnea de impacto cerebral.296 La apnea de impacto cerebral puede agravar el curso de la lesión cerebral traumática y puede conducir a la asfixia si no se trata. El manejo efectivo de las vías respiratorias y la ventilación con oxígeno pueden prevenir y revertir el paro cardíaco hipóxico. En un reciente estudio nacional holandés, el 52 % del paro cardíaco traumático se atribuyó a la apnea relacionada con una lesión cerebral traumática.297La ventilación controlada en pacientes comprometidos con la circulación se asocia con riesgos importantes debido al aumento de la presión intratorácica298,299 que puede conducir a una mayor disminución del gasto cardíaco causado por:•Impidió el retorno venoso al corazón, particularmente en hipovolemia grave.•Reducción del llenado diastólico, particularmente en el taponamiento cardíaco•Conversión del neumotórax en neumotórax de tensión•Aumento de la pérdida de sangre de los sitios de sangrado venosoMinimizar la presión intratorácica utilizando volúmenes corrientes bajos y PEEP mínima puede ayudar a optimizar la precarga cardíaca. La ventilación debe ser monitoreada con capnografía y ajustada para lograr la normocapnia.265,300,301
Neumotórax por tensión
El neumotórax tensional es una causa reversible de paro cardíaco y debe excluirse en el paro cardíaco traumático. Puede conducir a un paro cardíaco al obstruir el retorno venoso a través del cambio mediastínico y perjudicar el intercambio efectivo de gases. La ventilación de presión positiva puede convertir un simple neumotórax en un neumórax de tensión.302 La prevalencia de neumórax de tensión es de aproximadamente el 0,5 % en todos los pacientes con traumatismos mayores tratados en el entorno prehospitalario y el 13 % de los desarrollan un paro cardíaco traumático.278 El diagnóstico de neumotórax de tensión en un paciente con paro cardíaco o inestabilidad hemodinámica debe basarse en un examen clínico o POCUS. Los síntomas incluyen compromiso hemodinámico (hipotensión o paro cardíaco) junto con signos sugestivos de un neumotórax (dificultad respiratoria previa, hipoxia, ausencia de sonidos respiratorios unilaterales en la auscultación, enfisema subcutáneo y desplazamiento mediastínico con desviación traqueal y distensión venosa yugular).302 La presentación de un neumotórax de tensión no siempre es clásica, pero cuando se sospecha en presencia de paro cardíaco o hipotensión grave, la descompresión torácica por toracostomía abierta debe llevarse a cabo de inmediato. Para descomprimir el tórax en un paro cardíaco traumático, realice toracostomías bilaterales en el cuarto espacio intercostal en la línea axilar media, permitiendo la extensión a una toracotomía con concha si es necesario. Se debe intentar la toracocentesis con aguja si el proveedor no es competente para realizar una toracostomía, o si los instrumentos quirúrgicos necesarios no están disponibles de inmediato.303-306
Tamponamiento cardíaco y toracotomía de reanimación
El taponamiento cardíaco es una causa frecuente de paro cardíaco en el trauma torácico penetrante. Aquellos con la capacidad clínica, la competencia y el equipo para realizarlo, pueden restaurar la circulación con toracotomía reanimadora inmediata a través de una concha o una incisión anterolateral izquierda.307,308 Una revisión sistemática sobre la pericardiocentesis con aguja en el taponamiento cardíaco traumático concluyó que sigue habiendo un papel limitado para este método en centros sin trauma donde el manejo quirúrgico definitivo no está disponible de inmediato.309Si bien la toracotomía de reanimación a menudo se realiza para el alivio del taponamiento cardíaco, no está indicada exclusivamente para esta condición. La toracotomía reanimativa también es aplicable para el control directo de la hemorragia, el pinzamiento cruzado aórtico y las compresiones cardíacas abiertas.282Una revisión sistemática reciente y un metaanálisis examinaron la toracotomía de reanimación en el trauma torácico civil, analizando 49 estudios tanto en entornos prehospitalarios como del departamento de emergencia.251 El estudio encontró que el tiempo es crítico, ya que realizar la toracotomía de reanimación prehospitalaria más de cinco minutos después de la llegada a la escena se asoció con un aumento de las complicaciones neurológicas, mientras que un retraso de más de diez minutos desde el encuentro inicial hasta la toracotomía de reanimación se vinculó a tasas de mortalidad más altas. Los pacientes con una puntuación de gravedad de lesiones de 25 o superior y aquellos sin signos de vida también tuvieron peores resultados. En general, la mortalidad fue mayor en la toracotomía de reanimación prehospitalaria (93,5 %) en comparación con la toracotomía de reanimación de urgencias (81,8 %) (P = 0,02). Entre los casos de toracotomía de reanimación en el departamento de emergencias, los pacientes con traumatismo contundente tuvieron una mortalidad significativamente mayor (92,8 %) en comparación con los pacientes con trauma penetrante (78,7 %) (P < 0,001). En resumen, la toracotomía de reanimación de emergencia es una intervención de alto riesgo, con mejores tasas de supervivencia en el hospital, y la intervención oportuna dentro de 5-10 minutos es crucial para mejorar los resultados. Los pacientes con traumatismos contundentes tienen peores perspectivas de supervivencia en comparación con aquellos con lesiones penetrantes.Los requisitos previos para una toracotomía de reanimación exitosa se pueden resumir como la «regla de las cuatro E»:•Experiencia: los equipos que realizan toracotomías de reanimación deben estar dirigidos por un profesional de la salud altamente capacitado y competente. Estos equipos deben operar bajo un marco de gobernanza sólido.•Equipo: es obligatorio el equipo adecuado para realizar la toracotomía de reanimación y para lidiar con los hallazgos intratorácicos.•Entorno: idealmente, la toracotomía de reanimación debe realizarse en un quirófano. La toracotomía de reanimación no debe llevarse a cabo si hay un acceso físico inadecuado al paciente, o si no es fácil llegar al hospital receptor.•Tiempo transcurrido: el tiempo desde la pérdida de los signos vitales hasta el inicio de una toracotomía de reanimación no debe ser más de 15 minutosSi no se cumple alguno de los cuatro criterios, la toracotomía de reanimación es inútil y expone al equipo a riesgos innecesarios.310 Un estudio de cohorte retrospectivo encontró que la toracotomía de reanimación prehospitalaria para el paro cardíaco traumático se asoció con el 3,8 % de los pacientes que sobrevivieron con un resultado neurológico favorable, todos que presentan tamponamiento cardíaco después de un trauma penetrante, y ninguno de los pacientes con exsanguinación u otra patología sobrevive con un resultado neurológico favorable. No hubo sobrevivientes más allá de 15 minutos de paro cardíaco traumático por taponamiento cardíaco y 5 minutos después de un paro cardíaco inducido por exsanguinación.311
Cuidados posteriores a la reanimación después de un paro cardíaco traumático
Como con todas las etiologías de paro cardíaco, la optimización del gasto cardíaco es esencial para restaurar la oxigenación y satisfacer las demandas metabólicas de la fisiología posterior al paro. Esto incluye la reanimación con fluidos y el apoyo vasopresor según sea necesario para mantener una perfusión tisular adecuada y el suministro de oxígeno. La tomografía computarizada temprana de todo el cuerpo puede ayudar a identificar lesiones mayores y guiar el manejo inicial después de ROSC al detectar afecciones potencialmente mortales, como hemorragia en curso, neumotórax o tamponeo cardíaco, que pueden requerir una intervención inmediata.El principio de la reanimación de control de daños se defiende para la hemorragia no controlada en el trauma. La reanimación de control de daños integra la hipotensión permisiva, la reanimación hemostática y la cirugía de control de daños. La evidencia apoya un enfoque conservador de fluido IV, manteniendo la presión arterial en un nivel no superior al necesario para mantener un pulso radial, hasta que se logre la hemostasia quirúrgica. Sin embargo, se necesita precaución en la lesión cerebral traumática, donde el aumento de la presión intracraneal puede requerir una presión arterial más alta para lograr una presión de perfusión cerebral suficiente. La duración de la reanimación hipotensiva no debe exceder los 60 minutos, ya que el riesgo de daño irreversible en los órganos supera sus beneficios.312–314El control de la temperatura es crucial, ya que la hipotermia exacerba la coagulopatía, la acidosis y la inestabilidad hemodinámica (la «triada letal»). Para evitar un mayor deterioro, las estrategias de calentamiento activo, incluido el calentamiento de fluidos, los dispositivos de calentamiento externos y el mantenimiento de un entorno de reanimación óptimo, deben implementarse temprano.El manejo de la coagulación es un componente clave de la reanimación, ya que la coagulopatía inducida por el trauma puede empeorar la hemorragia y la disfunción orgánica. Las estrategias incluyen la administración temprana de productos sanguíneos (por ejemplo, plasma, plaquetas, fibrinógeno o sangre entera), ácido tranexámico y monitoreo de la coagulación en el punto de atención para guiar la terapia hemostática dirigida.
Ajustes especiales
Paro cardíaco en el laboratorio de cateterismo
La aparición y los resultados del paro cardíaco en el laboratorio de cateterismo cardíaco («laboratorio catetro») varían según el entorno, el perfil del paciente y el tipo de intervención realizada. Los casos van desde procedimientos electivos de rutina hasta el tratamiento emergente de pacientes críticos con isquemia cardíaca, shock o arritmias potencialmente mortales. Además, las intervenciones cardíacas estructurales, a menudo dirigidas a pacientes de edad avanzada y de alto riesgo, son cada vez más frecuentes y complejas. Las causas de paro cardíaco, entre otras, en este entorno incluyen isquemia grave, tamponamiento, arritmias, perforación/disección vascular o anafilaxia.Una reciente revisión del alcance de ILCOR315 estimó la incidencia general de paro cardíaco en el laboratorio de cateterismo entre 0,2 % a 0,5 % en todos los procedimientos.316,317 Para la ICP, la incidencia es ligeramente mayor (0,8-2 %),318–320 y para el infarto de miocardio con elevación del segmento ST aún más alto (STEMI – 1,9 % a 5,5 %), principalmente con un ritmo inicial de fibrilación ventricular.321-325Las tasas generales de supervivencia iniciales oscilan entre el 67 % y el 77 % en el momento del evento316,317,326 y entre el 38 % y el 56 % en el alta hospitalaria.317,326 Para la ICP y el IMCEST, la supervivencia hasta el alta es mayor (82-100 %).321,322,325
Prevenir y estar preparado
La educación adecuada es esencial para garantizar los mejores resultados de paro cardíaco en el laboratorio de cateterismo. El personal debe estar capacitado en soporte vital avanzado y preparado para reconocer y manejar rápidamente los riesgos y complicaciones específicos del procedimiento, incluyendo el ritmo, la pericardiocentesis, el inicio de dispositivos de asistencia ventricular o la ECPR. El equipo de emergencia debe ser funcional y fácilmente disponible (ver Fig. 16).
os estudios apoyan los simulacros de emergencia de simulación periódica para mejorar las habilidades técnicas y no técnicas en el laboratorio de cateterismo.327 La capacitación en habilidades no técnicas tiene el potencial de minimizar los errores en este entorno.328 Se recomienda una cuidadosa evaluación de riesgo-beneficio y la planificación de procedimientos electivos para minimizar las complicaciones. Se ha informado que el uso de listas de verificación de seguridad es eficaz para reducir los errores humanos y ha resultado en menos complicaciones.329
Detectar y reaccionar
Los parámetros vitales monitoreados del paciente, incluido el ECG, deben revisarse regularmente para detectar complicaciones tempranas. La ecocardiografía debe ser fácilmente accesible en caso de inestabilidad hemodinámica o sospecha de complicaciones (por ejemplo, taponamiento cardíaco). La ecocardiografía transesofágica (TOE), a menudo utilizada para monitorear las intervenciones cardíacas estructurales en el laboratorio de cateterismo, puede facilitar la detección temprana de complicaciones con imágenes de mayor calidad y precisión.330El paro cardíaco en el laboratorio de cateterismo debe provocar una llamada inmediata de ayuda y la activación del equipo de reanimación.316 Si bien el personal del laboratorio de cateterismo debe iniciar rápidamente la RCP, se necesita apoyo adicional para mantener la RCP mientras se abordan las causas reversibles. Dependiendo de la sospecha de complicación subyacente o la causa de la detención, también se debe alertar al equipo de cirugía cardíaca. Es importante destacar que, como lo destaca las directrices de las Sociedades Británicas Conjuntas sobre el manejo del paro cardíaco en el laboratorio de cateterismo,331 todos los miembros del equipo de emergencia deben llevar delantales de plomo antes de entrar, ya que la fluoroscopia a menudo puede ser necesaria. Asegúrese de que un suministro adecuado de delantales de plomo, protección para los ojos y la tiroides esté disponible de antemano.
Reanimar y tratar posibles causas
El paro cardíaco en el laboratorio de cateterismo debe manejarse generalmente de acuerdo con las Directrices del ERC 2025 ALS,164 con algunas modificaciones. En presencia de VF/pVT monitoreado, se recomienda la desfibrilación inmediata con hasta tres choques apilados si persiste un ritmo shockable antes de comenzar las compresiones torácicas. Este enfoque se alinea con las recomendaciones para los arrestos presenciados en pacientes monitoreados con un ritmo de choque cuando un desfibrilador está fácilmente disponible. En caso de PEA/asistolia, se debe iniciar la RCP y se debe inyectar adrenalina. Sin embargo, la bradicardia extrema puede tratarse con estimulación temporal externa o transvenosa, especialmente si surge de un bloqueo auriculoventricular que complica ciertos procedimientos, como el implante de la válvula transaórtica, las intervenciones de la válvula tricúspide o la ablación con catéter. Durante el paro cardíaco, pueden ser necesarios procedimientos invasivos para corregir causas reversibles (como ICP, pericardiocentesis o inicio del dispositivo de soporte mecánico) durante la RCP en curso o inmediatamente después de ROSC.331
Ultrasonido en el punto de atención (POCUS)
ILCOR revisó la precisión diagnóstica de POCUS en la detección de causas reversibles de paro cardíaco en diferentes escenarios, concluyendo que la evaluación de POCUS puede considerarse durante el paro cardíaco en el laboratorio de cateterismo si la realiza personal experimentado sin interrumpir la RCP, especialmente cuando se sospecha clínicamente una causa reversible específica.332 En pacientes que ya se someten a TOE en el momento del paro cardíaco, se podría considerar mantener la sonda TOE en su lugar si la vía aérea está asegurada, ya que el TOE puede ofrecer retroalimentación adicional y ayudar a guiar la ECPR o la colocación del dispositivo de soporte mecánico si lo realiza un operador capacitado, sin interferir con la compresión torácica. Sin embargo, el uso de estas herramientas no debe comprometer la adhesión al protocolo de ELA.
RCP mecánica
Una revisión sistemática de ILCOR evaluó el impacto de los dispositivos mecánicos de compresión torácica en comparación con la compresión manual en los resultados del paro cardíaco,242 y encontró evidencia en contra del uso rutinario de compresiones torácicas mecánicas automatizadas para reemplazar las compresiones manuales para el paro cardíaco en el hospital. Sin embargo, la RCP mecánica se consideró una alternativa razonable cuando las compresiones manuales de alta calidad pueden comprometer la seguridad del proveedor o interferir con procedimientos críticos, como los realizados en el laboratorio de cateterismo. Además, la revisión del alcance de ILCOR sobre el paro cardíaco en el laboratorio de cateterismo315 describió los resultados del paro cardíaco en el laboratorio de cateterismo después del uso de RCP mecánica, principalmente durante la ICP o la canulación para soporte circulatorio mecánico o RCP extracorpórea. Las cohortes mixtas incluidas en los estudios restantes y el informe de resultados inconsistentes dificultaron la interpretación, por lo que los resultados generales en este entorno son inciertos. Hasta que se produzcan nuevas pruebas, la RCP mecánica se puede usar en el laboratorio de cateterismo siguiendo las consideraciones de ILCOR CoSTR discutidas anteriormente.242 Es importante destacar que, si se usa, las pausas durante la colocación del dispositivo deben minimizarse y se debe garantizar la posición correcta para evitar lesiones viscerales.
RCP extracorpórea
El uso de la oxigenación de membrana extracorpórea venoarterial (VA-ECMO) para apoyar a los pacientes con paro cardíaco refractario (ECPR) fue actualizado recientemente por ILCOR.243 En el entorno hospitalario, la ECPR se consideró como una terapia de rescate para pacientes seleccionados con paro cardíaco refractario si la implementación es factible. Una reciente revisión de alcance de ILCOR315 cubrió el uso de ECPR en el laboratorio de cateterismo. La mayoría de la evidencia se deriva del registro de la Organización de Soporte Vital Extracorpóreo con un 39 % de supervivencia hasta el alta hospitalaria.333 A pesar de sus ventajas potenciales para mantener la reanimación mientras aborda las causas reversibles, la evidencia es limitada debido a la heterogeneidad del estudio y al alto riesgo de sesgo. Sin embargo, teniendo en cuenta la relación riesgo-beneficio, la ECPR puede considerarse para pacientes seleccionados de paro cardíaco en el laboratorio de cateterismo en función de las circunstancias clínicas, los recursos disponibles y la experiencia. La ECPR facilita la realización de procedimientos diagnósticos o terapéuticos, incluyendo angiografía/angioplastia coronaria, embolectomía pulmonar o cirugía cardíaca.
Soporte circulatorio mecánico
Se puede utilizar una variedad de dispositivos temporales en el laboratorio de cateterismo para ayudar a la función de bombeo cardíaco, ofreciendo diferentes niveles de soporte hemodinámico para insuficiencia cardíaca grave o durante procedimientos de alto riesgo. Los ejemplos comunes incluyen la bomba de globo intraaórtico, Impella®, TandemHeart® o VA-ECMO.El uso de dispositivos mecánicos de soporte circulatorio para el shock cardiogénico después de ROSC en cualquier entorno fue abordado por ILCOR.334 Esto no mostró ningún beneficio de supervivencia en diferentes puntos de seguimiento al comparar el uso temprano de dispositivos de rutina con la atención estándar. Sin embargo, la mayoría de las pruebas se derivan de pacientes con shock cardiogénico en lugar de aquellos específicamente reanimados de un paro cardíaco. En resumen, el apoyo circulatorio mecánico en pacientes con shock cardiogénico después de ROSC en el laboratorio de cateterismo puede considerarse en casos seleccionados. Las decisiones individualizadas deben considerar el cuadro clínico, la disponibilidad de dispositivos y la experiencia del equipo. Cuando se usa, se recomienda una estrecha monitorización de complicaciones para garantizar un manejo rápido.
Adrenalina intracoronaria
La reciente revisión del alcance de ILCOR sobre el paro cardíaco en el laboratorio de cateterismo incluyó una comparación de la adrenalina intracoronaria con la administración intravenosa periférica o venosa central.334 La adrenalina a través de las vías intravenosas centrales e intracoronarias se asoció con tasas más altas de ROSC, supervivencia hasta el alta hospitalaria y supervivencia con buenos resultados neurológicos en comparación con la administración intravenosa periférica. Sin embargo, la administración intracoronaria se asoció con un mayor riesgo de trombosis del stent. A pesar de estos hallazgos prometedores, la evidencia actual es insuficiente para recomendar la administración intracoronaria rutinaria de adrenalina durante el paro cardíaco en el laboratorio de cateterismo.
Ahogamiento
Una vez que la Organización Mundial de la Salud reconoció el ahogamiento accidental como un grave problema de salud pública, especialmente en entornos de bajos recursos, las muertes anuales en todo el mundo por ahogamiento disminuyeron de 370.000 en 2000 a 300.000 en 2021335. Esta disminución podría atribuirse a la legislación y las regulaciones (por ejemplo, vallas de piscina y uso obligatorio de chalecos salvavidas),336, así como a medidas preventivas efectivas (por ejemplo, guarderías para niños y capacitación en seguridad en el agua).337 Los ahogamientos fatales están asociados con varios factores de riesgo: 1) sexo: los hombres representan hasta seis veces más ahogamientos que las mujeres; 2) edad: aunque en Europa el ahogamiento es la cuarta causa principal de muerte en niños de 5 a 14 años, los mayores de 50 años tienen la mayor incidencia; 3) ubicación: las vías fluviales representan un riesgo significativo; 4) circunstancias como el consumo de alcohol y el estado migratorio aumentan la probabilidad de ahogamiento. Las estadísticas de la OMS no incluyen las muertes por ahogamiento causado por suicidio (la causa más frecuente de muerte por ahogamiento en varios países europeos), accidentes de transporte o desastres naturales como inundaciones.338-340 La mayoría de los ahogamientos mortales nunca llegan al sistema de salud porque el rescate o la recuperación a menudo ocurren demasiado tarde para la intervención médica.341Las recomendaciones se basan en una revisión de alcance en 2021 y una revisión sistemática en 2023.342,343 No hay ECA. La mayoría de las recomendaciones son declaraciones de buenas prácticas u opiniones de expertos basadas en evidencia indirecta y están en línea con las declaraciones de posición de la Comisión Médica de la Federación Internacional de Salvamento.344El ahogamiento se define como «el proceso de experimentar un deterioro respiratorio por inmersión o inmersión en líquido».345 La inmersión es una situación en la que la persona permanece en un líquido con las vías respiratorias por encima de la superficie líquida, mientras que la inmersión se refiere al estado en el que las vías respiratorias permanecen sumergidas. Cuando la discapacidad respiratoria progresa durante la inmersión, el corazón se ralentiza y finalmente se detiene debido a la hipoxia prolongada, y solo la reanimación puede evitar que el mecanismo de ahogamiento se vuelva fatal.346,347 El tiempo de inmersión es el factor pronóstico más robusto e independiente.348 El BLS CoSTR 2020 para adultos recomienda el tiempo de inmersión como el único indicador que guía el pronóstico y las decisiones con respecto al manejo clínico y las operaciones de búsqueda y rescate.349 Menos de 5-10 minutos de inmersión se asocia con un mejor pronóstico.348-350El alcance del daño pulmonar depende de la cantidad y el grado de contaminación del agua aspirada.346 La salinidad no tiene valor predictivo probado.348,349,351El conflicto autonómico, causado por la estimulación simultánea del sistema nervioso autónomo simpático y parasimpático puede explicar la génesis de arritmias cardíacas en circunstancias con inmersión en agua fría y retención de la respiración.352 En el ahogamiento, la baja temperatura del agua puede ejercer un efecto protector al reducir el metabolismo cerebral.346,348,349 Sin embargo, este fenómeno es extremadamente raro y es más probable en individuos pequeños que se enfrían rápidamente en agua por debajo de 6 °C.353 Se ha informado de una inmersión durante más de 60 minutos con buenos resultados neurológicos,354 particularmente en niños sumergidos en agua fría, antes de la inmersión.354,355 Estos informes sugieren que si la temperatura del agua está por encima de 6 °C, la supervivencia o la reanimación exitosa se convierte en extremadamente improbable después de unos 30 minutos de inmersión, mientras que en agua a o por debajo de 6 °C, este umbral puede extenderse a alrededor de 90 min.354
Rescate acuático
Se necesita rescate acuático para prevenir el ahogamiento, interrumpir el ahogamiento y proporcionar una intervención inmediata que salve vidas. Muchas personas no entrenadas han muerto mientras intentaban un rescate.356 Los rescatistas nunca deben ponerse deliberadamente en peligro. Por esta razón, se recomienda encarecidamente que los transeúntes, especialmente aquellos que no pueden nadar, no entren en aguas profundas. En cambio, deberían confiar en métodos de rescate indirecto, como el uso de equipos de rescate públicos, lanzar cualquier dispositivo de flotación disponible o alcanzar un objeto largo, mientras buscan asistencia profesional. Los socorristas con capacitación de rescate tienen las competencias para seleccionar y aplicar la técnica de rescate adecuada, el material de rescate y los dispositivos de flotación cuando sea posible.357 El material de rescate y los dispositivos de flotación también reducen el tiempo de rescate.357La fatiga física es un factor limitante cuando se requiere RCP, especialmente después del rescate acuático.358,359 Si es posible, una persona no involucrada en el rescate debe realizar RCP.357 Las lesiones espinales son poco comunes después de ahogarse.360 La estabilización espinal no debe retrasar la evaluación de los signos vitales o la reanimación. Si no se necesita reanimación y hay signos claros de una lesión en la columna cervical, se recomienda que al menos tres personas lleven a cabo la restricción del movimiento de la columna durante la extricación del agua, preferiblemente con al menos uno de ellos específicamente entrenado en el procedimiento.361 Si las personas requeridas no están disponibles, la extricación no debe posponerse más. En cada situación de una lesión en la columna vertebral en el agua, los servicios médicos de emergencia deben ser alertados de inmediato.
Paro cardíaco causado por ahogamiento
La evidencia mostró un mejor pronóstico cuando las personas ahogadas son ventiladas al iniciar la RCP.362-364 Por esta razón, la ventilación en el agua y la reanimación a bordo están ganando aceptación dentro de la comunidad que salva vidas, ya que estas técnicas son factibles con el entrenamiento.342,362,365-367. En la práctica, algunas circunstancias no permiten esto. Por ejemplo, debido a la falta de entrenamiento, la ausencia de equipo de flotación o las condiciones del agua. Entonces, es más práctico esperar hasta que la víctima esté en tierra.En tierra, los socorristas y los EMS deben seguir el enfoque ABC.362,365 La RCP debe comenzar con 5 ventilaciones. Si la persona permanece inconsciente sin una respiración normal, continúe con la RCP estándar (Fig. 9). Solo se recomienda iniciar la RCP con compresión si el rescatador no está dispuesto a proporcionar ventilaciones.368Para simplificar, los transeúntes no capacitados deben comenzar con compresiones torácicas, mientras que los proveedores de primeros auxilios capacitados deben considerar las ventilaciones, ya que el tiempo para la ventilación es fundamental para restaurar el paro cardíaco en víctimas ahogadas. En el paro respiratorio aislado, las ventilaciones pueden prevenir el paro cardíaco (ver Fig. 10).En el ahogamiento, un ritmo inicial de choque está presente en menos del 10 % de los casos debido a la respuesta cardíaca a la hipoxia. Aunque las víctimas retiradas del agua podrían estar en paro cardíaco debido a una causa cardíaca, por ejemplo, debido a las arritmias causadas por el conflicto autonómico352 o la presencia de enfermedad cardiovascular,369 la RCP no debe retrasarse mediante la aplicación de DEA.Se debe suministrar oxígeno temprano porque el ahogamiento es un evento respiratorio. Sin embargo, un estudio reciente mostró que es difícil proporcionar evidencia del impacto del oxígeno en el pronóstico.370 El manejo de las vías respiratorias debe basarse en las competencias y la capacitación del socorrista o EMS.365 La intubación traqueal en comparación con los dispositivos de las vías respiratorias supraglóticas se asoció con un ROSC más alto, pero no se asoció con la supervivencia o un resultado neurológico favorable en un mes.371
Impacto de la hipotermia
La mayoría de las víctimas ahogadas son hipotérmicas (temperatura corporal central < 35 °C), lo que afecta el diagnóstico, el tratamiento y el pronóstico.346,348,372,373 En general, las pautas para la hipotermia accidental también se pueden aplicar a las víctimas ahogadas con hipotérmicas, incluida la verificación de signos vitales de un minuto, la medición precisa de la temperatura central, el tratamiento alternativo con respecto a la desfibrilación, el uso de medicamentos cuando la temperatura corporal es inferior a 30 °C y el acceso al calentamiento de soporte vital extracorpóreo.372 La hipotermia refleja un tiempo de inmersión más largo, lo que resulta en peores resultados neurológicos. Sin embargo, cuando se produce ahogamiento en agua fría, generalmente considerada por debajo de 6 °C, y notablemente después de un período de inmersión, la hipotermia asociada puede ejercer un efecto neuroprotector.374El BLS CoSTR 2020 para adultos sugiere no usar la temperatura del agua al tomar decisiones pronósticas349 y no existen directrices específicas para indicar con precisión cuándo pasar del rescate a la recuperación, una postura que también reconoce la exclusión de resultados favorables raros en aguas heladas. Esto se debe en parte a la amplia variedad de escenarios de ahogamiento con respecto al tiempo de inmersión, la temperatura del agua, los recursos disponibles o los peligros ambientales. Algunas agencias o países tienen protocolos locales o nacionales. En ausencia de una orientación definitiva, es crucial que los que están en la escena lleguen a un consenso sobre el punto en el que una mayor intervención médica se considera inútil.374
Paro cardíaco en el quirófano (OR)
El paro cardíaco en el quirófano es un evento raro con una incidencia de alrededor de 3/10.000 anestésicos,375-377 con una mayor incidencia en entornos de bajos recursos,378 en pacientes mayores más frágiles, y en recién nacidos y bebés.379,380 La tasa de supervivencia general es > 50 %.381 Los fuertes predictores de paro cardíaco intraoperatorio son puntuaciones más altas en el estado físico de la Sociedad Americana de Anestesiólogos (ASA), la sepsis, el caso urgente o de emergencia, la complejidad del caso, la técnica de anestesia y la edad.381 Las principales son las complicaciones durante la cirugía cardíaca, la hemorragia mayor, las bradiarritmias y el shock séptico.378,381
Detalles del paro cardíaco intraoperatorio y su tratamiento
En su mayoría, el deterioro fisiológico gradual conduce a un paro cardíaco intraoperatorio.382 El tratamiento del paro cardíaco en el quirófano sigue el algoritmo general de la ELA. Sin embargo, se requieren varias modificaciones destinadas a identificar causas reversibles. Las intervenciones clave incluyen pedir ayuda de inmediato, informar al equipo quirúrgico y de anestesia y garantizar la presencia de personas suficientemente capacitadas.Los pacientes quirúrgicos de alto riesgo a menudo son monitoreados con presión arterial invasiva previa a la detención. Propuestas recientes sugieren comenzar la compresión torácica si la presión arterial sistólica se mantiene por debajo de 50 mmHg a pesar de las intervenciones para tratar la causa subyacente.375,383,384 La caída repentina en ETCO2 en tales casos es un fuerte indicador de paro cardíaco. Ajuste la posición y la altura de la mesa de operaciones o el carro para optimizar la entrega de compresiones torácicas de alta calidad.Los bajos valores iniciales de capnografía terminal (ETCO2 < 2,7 kPa o 20 mmHg) están relacionados con una calidad de compresión torácica inadecuada, lo que indica la necesidad de mejora y posiblemente sugiere fatiga del rescatador.385–387 Para los pacientes previos a la detención (PAS < 50 mmHg), se han propuesto bolos incrementales iniciales de 50-100 µg de adrenalina por vía intravenosa, en lugar del bolo estándar de 1 mg. En pacientes previos la detención, dosis más altas de adrenalina pueden inducir hipertensión grave o taquiarritmias. Si un bolo de adrenalina en dosis baja falla, se debe administrar el 1 mg estándar de adrenalina intravenosa.375,388En circunstancias en las que la probabilidad de paro cardíaco es alta, un desfibrilador debe estar fácilmente disponible en modo de espera y se deben aplicar electrodos de desfibrilación autoadhesivos antes de la inducción de la anestesia. La desfibrilación segura debe realizarse inmediatamente en caso de un ritmo impactante. Garantizar un acceso venoso adecuado, preparar medicamentos y líquidos de reanimación, establecer un manejo avanzado de las vías respiratorias (si aún no se ha realizado) y utilizar un ventilador mecánico que entregue el 100 % de oxígeno lo antes posible.389 Los datos actuales sugieren que la ventilación mecánica produce un PaO2 similar al de la ventilación manual con una bolsa autoinflable.390-393 Si hay un ecografista calificado capaz de realizar ultrasonido (transtorácico/transofágica) con interrupciones mínimas en las compresiones torácicas, se debe ser convocado para ayudar al diagnóstico.389La compresión torácica se realiza de manera óptima en posición supina, pero en caso de un paro cardíaco en posición prona con una vía aérea avanzada en su lugar, siga la Declaración de Buenas Prácticas de ILCOR para iniciar la RCP en posición prona.394,395 Considere la posición simultánea del decúbito lateral izquierdo y la cabeza hacia abajo en casos de embolia aérea masiva396-398 si no afecta la calidad de la compresión torácica.La identificación de causas reversibles debe priorizarse y tratarse adecuadamente:•Si la detención es causada por una pérdida significativa de sangre, las compresiones torácicas son efectivas solo si el volumen circulante se reemplaza simultáneamente y el control de la hemorragia (por ejemplo, cirugía, endoscopia, técnicas endovasculares) se inicia de inmediato.389•En casos de exsanguinación subdiafragmática grave, se puede considerar la oclusión de balón endovascular reanimador de la aorta (REBOA) en un intento de ralentizar el agotamiento del volumen intravascular. Sin embargo, hay pocas pruebas sobre la mejora de la supervivencia y se requieren más estudios para dilucidar el beneficio potencial.389,399,400•La ECPR debe considerarse en los casos en que la RCP convencional falla o cuando se requiere una reanimación prolongada.•Las compresiones cardíacas abiertas solo deben ser realizadas por profesionales de la salud capacitados en casos de paro cardíaco intraoperatorio o como parte de la toracotomía de reanimación para pacientes traumatizados.•Si la detención ocurre durante la cirugía laparoscópica o robótica, considere liberar cualquier neumoperitoneo y desinflar el abdomen para mejorar el retorno venoso durante la RCP; durante la toracoscopia, detenga la insuflación de CO2 y descarte el neumotórax contralateral.•Para otras causas reversibles, consulte los subcapítulos específicos de estas directrices.
Factores humanos en el paro cardíaco intraoperatorio
Como en todos los eventos de reanimación, un líder de equipo designado debe dirigir y coordinar al equipo de reanimación y a sus asistentes, centrándose en compresiones y ventilaciones torácicas de alta calidad, minimizando los tiempos de no flujo, abordando las causas reversibles simultáneamente y evitando el enfoque en tareas de baja prioridad que distraen. La cirugía debe detenerse a menos que aborde una causa reversible de paro cardíaco. Puede ser necesario cubrir el campo quirúrgico para permitir el acceso al paciente y realizar tareas de reanimación.El manejo exitoso del paro cardíaco intraoperatorio requiere no solo habilidades técnicas individuales y una respuesta de equipo bien organizada, sino también una cultura de seguridad institucional integrada en la práctica diaria a través de la educación continua, la capacitación y la cooperación multidisciplinaria.8,401,402 Los protocolos institucionales para responder a posibles situaciones de arresto (por ejemplo, protocolos de transfusión masiva) y las listas de verificación ayudarán a optimizar la respuesta al paro cardíaco en el entorno del quirófano.8,403No hay evidencia que respalde el uso del control de temperatura hipotérmico después de un paro cardíaco intraoperatorio en adultos.404 Por lo tanto, el control de la temperatura posterior al paro debe seguir los protocolos locales posteriores a la reanimación.
Toxicidad sistémica de anestesia local
El paro cardíaco es una complicación rara de la sobredosis de anestésico local, que a menudo es causada por una inyección intravascular inadvertida. La acción directa de los anestésicos locales en los canales de sodio de los miocitos cardíacos causa colapso cardiovascular, generalmente dentro de 1 a 5 minutos, pero el inicio se informó de 30 segundos a 60 minutos.405,406 Los primeros síntomas son entumecimiento perioral, sabor metálico, mareos, tinnitus y visión borrosa seguido de hipotensión sustancial, disritmias y convulsiones generalizadas. El diagnóstico de emergencia a menudo se basa en la exclusión de otras causas.407,408 El manejo de las convulsiones implica la administración de benzodiazepinas en dosis incrementales (p. ej. Lorazepam IV 0,1 mg kg-1 IV, midazolam 0,05–0,1 mg kg-1 IV), seguido de dosis graduales de propofol o pentotal (hasta dosis de inducción) si es necesario. Se debe prestar atención a asegurar las vías respiratorias y mantener la ventilación mientras se previene el colapso cardiovascular durante la administración de medicamentos sedantes (especialmente propofol). La terapia lipídica intravenosa se recomienda como terapia de rescate para tratar el colapso cardiovascular y el paro cardíaco, aunque su uso se basa en evidencia de muy baja certeza,131,408-410 pero sin daños documentados.411 Una emulsión lipídica del 20 % (al menos 4 bolsas de 250 ml) debe estar disponible si se utilizan grandes dosis de anestésicos locales (por ejemplo, quirófanos, salas de parto, departamento de emergencias).409,412 Durante el paro cardíaco, después de un bolo IV de emulsión lipídico inicial del 20 % (1,5 ml/kg IV durante 1 min), se debe iniciar una infusión (0,25 ml kg-1 min IV). Si el ROSC no se logra en 5 minutos, la velocidad de infusión debe duplicarse con dos bolos adicionales a intervalos de 5 minutos.409,412 Se recomienda una dosis acumulativa máxima de 12 ml kg-1 IV 20 % de emulsión lipídica para evitar la sobrecarga de grasa.411 Se sugiere que la adrenalina IV se administre a una dosis más baja (≤1 μg kg-1) en la intoxicación anestésica local porque sus efectos aritromogénicos y acidóticos pueden impedir el ROSC sostenido, esto se ha demostrado en estudios con animales.409,413-416
Cirugía cardíaca
La incidencia de paro cardíaco después de la cirugía cardíaca es del 2 al 5 %, con tasas de supervivencia más altas (alrededor del 50 %) que son más altas que otras causas.417-421 Esto se debe en gran medida a la detección temprana y la alta incidencia de causas reversibles. Las causas comunes de paro cardíaco en este entorno incluyen arritmias que causan FV, que representan hasta el 50 % de los casos, seguidas de taponamiento cardíaco y sangrado mayor, que a menudo se presenta como PEA.Las recomendaciones basadas en la evidencia para el manejo del paro cardíaco después de la cirugía cardíaca se derivan de la Asociación Europea de Cirugía Cardiotorácica,422,423 el documento de consenso de expertos de la Sociedad de Cirujanos Torácicos para la reanimación de pacientes que se detienen después de una cirugía cardíaca,424 las Directrices de las Sociedades Británicas,425 y el ILCOR CoSTR para el Manejo de los receptores de dispositivos de asistencia del Ventrículo Izquierdo Implantables.426Garantizar una formación inicial y de actualización adecuada del personal en habilidades técnicas de reanimación, ELA y trabajo en equipo a través de escenarios simulados de cirugía cardíaca, incluida la capacitación para realizar una resternotomía de emergencia. El trabajo en equipo, incluidos factores humanos como la conciencia situacional y las habilidades de comunicación, debe incluirse en la capacitación y adquirirse a través de la práctica en escenarios simulados. Las funciones deben asignarse previamente al personal en cada entorno para garantizar una coordinación efectiva de los esfuerzos de reanimación.427El equipo de emergencia debe incluir pequeños conjuntos de resternotomía que contengan solo los elementos esenciales para abrir el pecho, estar estandarizado, estar adecuadamente marcado, fácilmente disponible donde los pacientes con intervenciones realizadas recientemente se estén recuperando y sean revisados periódicamente.423,424Las listas de verificación de seguridad reducen las complicaciones y la mortalidad en la cirugía no cardíaca y deben implementarse para el manejo del paro cardíaco en estos entornos.428
Detectar el paro cardíaco y activar el protocolo de paro cardíaco
Se pueden identificar signos tempranos de deterioro en el paciente postoperatorio monitoreado después de un examen cuidadoso. La hipotensión es un signo común de varias complicaciones postoperatorias (Tabla 9).429-431 Se debe realizar una ecocardiografía en caso de inestabilidad hemodinámica; considere la ecocardiografía transesofágica para un diagnóstico más preciso.432,433 El monitoreo continuo del ECG permite la identificación temprana de las arritmias; las taquicardias supraventriculares son las más frecuentes en este entorno.434
l paro cardíaco se puede detectar comprobando el ritmo del ECG, el examen clínico y la revisión de los signos vitales, incluidas las formas de onda de presión (presiones arteriales, venosas y pulmonares centrales, y oximetría de pulso) y ETCO2.423,424
Reanimar y tratar las posibles causas en la cirugía cardíaca
Las modificaciones clave en el algoritmo estándar de ELA incluyen la corrección inmediata de las causas reversibles y, si esto no tiene éxito, la resternotomía emergente.423,424.Reanimar y tratar las posibles causas:OInicie la reanimación de acuerdo con la ELA, pero con modificación:OVF/pVT: Aplicar hasta 3 choques consecutivos (<1 min).OAsístole/bradicardia extrema: Aplique un ritmo temprano – rendimiento máximo (<1 min).OPEA: Corregir causas potencialmente reversibles. Si el ritmo es acelerado, apague transitoriamente el ritmo para excluir el VF.Sin ROSC:OInicie la compresión y ventilación torácica.OConsidere POCUS/TOE.ORealice una resternotomía temprana (<5 min).OConsidere los dispositivos de soporte circulatorio y la ECPR
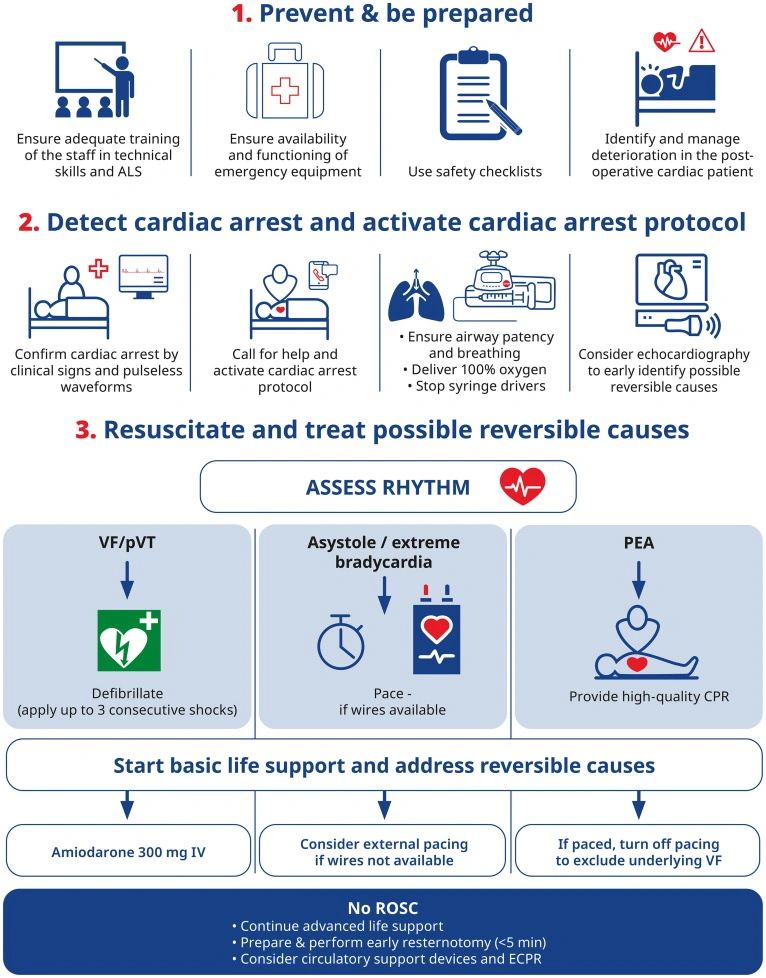
En pacientes con VF/pVT, se prioriza la desfibrilación de hasta tres choques apilados dentro de un tiempo máximo de 60 s.435,436 Si estos fallan, se recomienda la resternotomía inmediata y la desfibrilación interna.436 En caso de asístole o bradicardia extrema, se debe intentar la estimulación epicárdica (modo DDD a 80 a 100 latidos/min y a voltajes de salida máxima) o la estimulación transcutánea durante un minuto antes de iniciar las compresiones torácicas. La PEA debe desencadenar compresiones torácicas externas inmediatas, buscando causas reversibles y preparándose para una resternotomía temprana. En presencia de un ritmo estimulado sin pulso, pausar el ritmo para excluir el FV subyacente y, si está indicado, realizar desfibrilación.423,424Si el ROSC no se logra después de la desfibrilación o la estimulación, o en caso de PEA, se deben iniciar compresiones y ventilaciones iniciadas mientras se prepara para la resternotomía de emergencia. Realice compresiones externas a 100-120 latidos/min, con el objetivo de alcanzar una presión arterial sistólica > 60 mmHg; no alcanzar este valor a pesar del rendimiento adecuado puede indicar taponamiento o hemorragia grave, lo que requiere resternotomía de emergencia.423,424 En comparación con las compresiones externas, la compresión cardíaca interna proporciona una mejor presión de perfusión coronaria y sistémica, lo que puede justificar la reapertura torácica.437,438 El manejo de las vías respiratorias en este entorno sigue las indicaciones habituales para la ELA.En pacientes ventilados mecánicamente, verifique la posición y la permeabilidad del tubo traqueal, aumente el oxígeno inspiratorio al 100 % y elimine la presión espiratoria final positiva. Si se sospecha un neumotórax tenso, es necesaria la descompresión de emergencia.423,424
Medicamentos durante la reanimación
Como principio general, detenga todas las infusiones que no sean las necesarias para la reanimación. La amiodarona (300 mg) o la lidocaína (100 mg) se pueden administrar por vía intravenosa después de tres shocks fallidos para tratar el VF/pVT.424,439. Inyectar adrenalina (1 mg) poco después de la cirugía cardíaca es controvertida. La Asociación Europea de Cirugía Cardiotorácica y la Sociedad de Cirujanos Torácicos desaconsejan el uso rutinario de adrenalina basado en la preocupación de que la hipertensión intensa inducida por la adrenalina pueda causar sangrado o interrupción de las anastomosis quirúrgicas después de ROSC423,424,439, aunque se pueden considerar dosis más bajas (bolos de 50-100 mcg) en situaciones peri-arresta basadas en el consenso de expertos.375,388,424,429,437
POCUS y ecocardiografía transesofágico
En un paciente peri-parada después de una cirugía cardíaca, considere el POCUS transtorácico, aunque puede dar vistas limitadas de las cámaras cardíacas posteriores y cualquier taponamiento cardíaco posterior circundante. La ecocardiografía transesofágico (TOE) es una alternativa preferible, que da vistas más claras de 360° para incluir estructuras cardíacas posteriores, y permite compresiones torácicas ininterrumpidas. La presencia de taponamiento cardíaco, hemorragia intratorácica, derrames pleurales, hipovolemia, obstrucción dinámica del tracto de salida del ventrículo izquierdo y disección aórtica generalmente se puede identificar utilizando TOE.432,433,440-447 TOE puede evaluar la efectividad de las compresiones torácicas mediante imágenes en tiempo real del vaciado y llenado de cámaras cardíacas comprimidas, lo que potencialmente conduce al reposicionamiento de las manos para compresiones torácicas.448,449
Sterinotomía temprana
El paro cardíaco refractario requiere resternotomía dentro de los 5 minutos, para realizar compresiones cardíacas abiertas, liberar cualquier taponamiento y corregir las causas subyacentes. Este es un procedimiento seguro en la UCI,450 que conduce a tasas de supervivencia más altas, especialmente si se realiza con un retraso mínimo y en presencia de un problema quirúrgicamente reparable al reabrir.451 La 642otomía debe intentarse como parte del protocolo de reanimación de pacientes cardíacos hasta al menos el día 10 después de la operación.424
Dispositivos de soporte circulatorio
Bomba de globo intraaórtica
En pacientes apoyados por una bomba de balón intraaórtico que se presentan en paro cardíaco, el dispositivo puede contribuir a mejorar la perfusión coronaria y cerebral si se coordina con la compresión cardíaca (proporción 1:1, con amplificación máxima).452 El activador del ECG del balón no es confiable durante la reanimación y debe cambiarse al modo de activación de presión, o al modo interno a 100 latidos/min si las compresiones cardíacas se interrumpen durante un intervalo significativo.
RCP extracorpórea
La ECPR puede considerarse si la resternotomía no revierte el paro cardíaco o como un enfoque inicial, alternativa a la resternotomía, para pacientes sometidos a cirugía cardíaca mínimamente invasiva o aquellos que se detienen > 10 días después de la esternotomía inicial.424 Sin embargo, hay datos limitados que abordan este escenario específico, ya que la mayoría de los estudios se relacionan con el shock cardiogénico o poblaciones pediátricas.453
Dispositivos de asistencia del ventrículo izquierdo
Los dispositivos de apoyo circulatorio mecánico, especialmente los dispositivos de asistencia ventricular izquierda (LVAD) se están utilizando cada vez más como un puente hacia el trasplante de corazón o la recuperación en pacientes con insuficiencia cardíaca avanzada. Los pacientes con estos dispositivos a menudo carecen de signos clínicos tradicionales, como un pulso, incluso cuando hemodinámicamente estable y, por lo tanto, la evaluación del estado circulatorio mediante palpación, medición no invasiva de la presión arterial y oximetría de pulso puede ser difícil. El reconocimiento de paro cardíaco se basa en la ausencia de capacidad de respuesta y respiración. Cuando se realiza, se recomienda la RCP convencional. El riesgo de desplazamiento del dispositivo durante la RCP parece mínimo.425,426Las recomendaciones del ERC se basan en el ILCOR 2025 CoSTR y las directrices de las Sociedades Británicas 2025425,426sobre la gestión de emergencias en receptores de LVAD implantables en centros de trasplantes (Fig. 18).•Activación inmediata de equipos especializados para pacientes inconscientes con LVAD.•Inicie la RCP mientras intenta restaurar el dispositivo si hay varios rescatistas disponibles. Considere retrasar la RCP hasta 2 minutos para intentar restaurar el dispositivo si hay un solo rescatista presente.•Solucionar problemas del dispositivo como prioridad, siguiendo los protocolos pertinentes:OAlarmas de bajo flujo: Compruebe la capacidad de respuesta del volumen con la técnica de elevación de piernas. Si la alarma se resuelve y se confirma la hipovolemia, proceda con la reanimación con líquidos. Compruebe los valores de hemoglobina lo antes posible para evaluar el contexto de la hipovolemia, hemorragia o deshidratación. En casos de bajo flujo resultante de presión arterial alta, maneje la carga posterior con antihipertensivos.O Trombosis de la bomba: administre la anticoagulación o considere el soporte circulatorio mecánico como la ECMO.O Fallo eléctrico: Asegúrese de que la conexión a una fuente de alimentación y la integridad de las líneas eléctricas. Reemplaza las baterías o el controlador.O Arritmias: Se debe realizar desfibrilación o cardioversión si es necesario, asegurando una sedación adecuada si el paciente aún está consciente. Un LVAD funcional puede proporcionar suficiente perfusión cerebral incluso en corazones fibrilados.•Simultáneamente (si hay un segundo socorrista disponible) dirire las vías respiratorias, la respiración, el corazón (monitor/desfibrilador).•Determinar la adecuación de la circulación. Evalúe al paciente por MAP > 60 mmHg, ausencia de cianosis y presencia de un zumbido audible de LVAD. Es posible que se requieran ecocardiografía y monitoreo invasivo para una evaluación precisa. En casos de circulación inadecuada, considere el apoyo mecánico temporal o la cirugía correctiva. Si el dispositivo:OEstá funcionando bien y el paciente no está en insuficiencia circulatoria: Realice una evaluación ABCDE completa O Todavía no funciona o el paciente tiene insuficiencia circulatoria: Comience la RCP y–Considere la reapertura del pecho si < 10 días desde la implantación–Entregar ALS estándar, abordando 4H y 4 T.
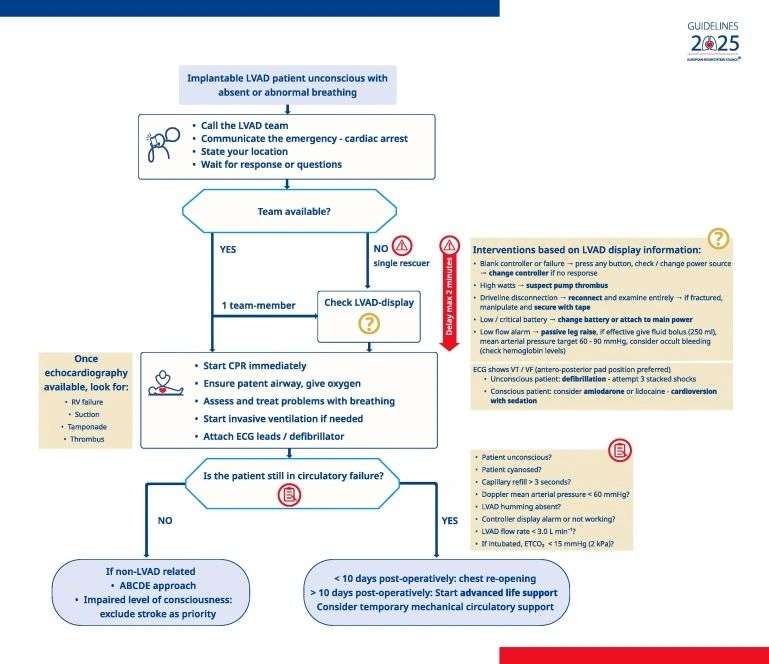
Paro cardíaco en los deportes
El riesgo absoluto de sufrir un paro cardíaco durante el ejercicio físico es pequeño.454 La incidencia de muerte cardíaca asociada con el deporte o el ejercicio en la población general se informa entre 0,46 y 6,8 por cada 100.000 personas-año.455-458 Grandes estudios poblacionales de paro cardíaco en atletas de los Estados Unidos y Europa indican diferencias regionales en las causas subyacentes de la muerte.459,460 Aproximadamente un tercio sobrevivió; la mayoría de los casos ocurrieron durante deportes competitivos o recreativos que no son de élite, y la RCP de los espectadores se realizó en un 75 %. En pacientes de edad ≤ 35 años, predominaron la enfermedad arterial coronaria prematura y el síndrome de muerte arrítmica súbita, seguido de miocarditis. En atletas de ≥ 35 años, predominaba la enfermedad arterial coronaria.461 La probabilidad de paro cardíaco relacionado con el deporte es mayor para los hombres de entre 40 y 60 años y con miocardiopatía preexistente. En el 22 % de los casos no se encontró ninguna patología y la supervivencia fue mejor con la reanimación temprana, el uso de DEA y la presencia de personal profesional.462 Se informa de las incidencias más altas para los jugadores de fútbol durante la competición y para la carrera y el ejercicio en el gimnasio durante la no competencia.463El paro cardíaco durante el deporte o el ejercicio requiere un reconocimiento rápido y un tratamiento efectivo si la persona afectada va a sobrevivir. La mejora de la supervivencia del paro cardíaco durante el deporte se atribuye a los eventos presenciados, la reanimación rápida y la disponibilidad de un AED.455.464 Esta evidencia respalda la importancia de planificar, adherirse e implementar BLS estándar en eventos deportivos propensos a eventos.Para aquellos atletas que tienen un ritmo cardíaco de choque durante el paro cardíaco, se deben administrar un mínimo de tres descargas en el campo de juego si el ritmo de choque persiste.El equipo médico debe considerar trasladar al atleta en paro cardíaco a un punto de encuentro designado, de la manera más segura y eficiente. Si eso no es posible, la RCP debe continuar en el campo.465 Estos planes deben ensayarse regularmente.A diferencia de los deportes profesionales, los atletas recreativos, aficionados y aficionados pueden ser menos conscientes del riesgo de paro cardíaco, lo que destaca la importancia de los programas de concientización. Iniciativas como la cooperación ERC-UEFA en 2024 durante los campeonatos europeos demuestran cómo las colaboraciones estratégicas entre organizaciones deportivas y de salud pueden crear conciencia y mejorar los resultados.466 Una vez que un atleta es reanimado con éxito, la evaluación cardiológica y el seguimiento exhaustivos son vitales antes de considerar un regreso al deporte.467
Prevención
No hay consenso entre las principales organizaciones sobre las medidas preventivas. El Comité Olímpico Internacional recomienda pruebas de detección cardíaca para los atletas. La Sociedad Europea de Cardiología recomienda un ECG de 12 derivaciones como herramienta de detección para todos los atletas jóvenes,467 pero la AHA y el Colegio Americano de Cardiología concluyen que no hay pruebas suficientes para apoyar esto como medida de detección.468,469 Los procesos aplicados a menudo siguen puntos de vista económicos en lugar de una perspectiva de atención médica. La prevención primaria incluye una historia dirigida y un examen físico, y la adición de un ECG de 12 derivaciones para al menos prevenir algunas muertes innecesarias, pero esto aún puede pasar por alto varias condiciones importantes asociadas con el paro cardíaco, incluidos los orígenes coronarios anómalos de alto riesgo, las aortopatías y las arritmias mediadas por adrenérgica. Más allá de un ECG, no hay datos suficientes para respaldar pruebas de rutina adicionales.470Para los participantes mayores en deportes y ejercicio, una evaluación médica de su riesgo individual debe incluir el nivel actual de actividad física, sus enfermedades cardiovasculares, metabólicas o renales conocidas, la presencia de los signos o síntomas que sugieren enfermedad cardiovascular y la intensidad del ejercicio deseada o anticipada.471 En este contexto, los enfoques de detección deben adaptarse a las características específicas y al perfil de riesgo de la población objetivo.467,470
Commotio cordis
Commotio cordis es una causa rara pero potencialmente fatal de paro cardíaco, desencadenada por un impacto contundente y no penetrante en el precordium, que generalmente ocurre dentro de una ventana de 20 milisegundos durante la fase ascendente de la onda T, induciendo VF.472,473 Históricamente se ha citado como una de las principales causas de paro cardíaco en atletas jóvenes, particularmente en deportes que involucran proyectiles de alta velocidad como el béisbol, lacrosse y el hockey474,475. En el fútbol, se ha informado de conmoción cordis en el 9 % de los paros cardíacos en jugadores ≤ 35 años de edad, con un 79 % de los casos causados por un impacto de pelota en el pecho.462Las tasas de supervivencia son de aproximadamente el 66 % en 2008-2023.474 La AC presenciada, el reconocimiento temprano, el inicio inmediato de la RCP y la desfibrilación rápida con un DEA siguen siendo los factores más importantes para la supervivencia474-477 Las tasas de supervivencia son del 40 % cuando se produce la reanimación en 3 minutos, pero caen a solo el 5 % cuando se retrasa más allá de esta ventana.475,476El equipo de protección, como los protectores de pecho en lacrosse, se ha introducido en un intento de prevenir la conmoción cordis, pero estudios recientes sugieren que no reducen el riesgo de FV en impactos críticos.478.479
Servicios médicos de emergencia (EMS) y transporte
El EMS desempeña un papel crucial en la cadena de supervivencia al proporcionar atención oportuna y de alta calidad a los pacientes que experimentan emergencias que amenazan su vida, incluido el paro cardíaco. Este capítulo proporciona recomendaciones basadas en la evidencia para prácticas de reanimación en el contexto de EMS (incluidos los servicios de transporte médico especializados) y el transporte.EMS recopila datos valiosos que pueden apoyar la mejora continua de la calidad y proporcionar retroalimentación a los proveedores de atención médica involucrados en la RCP.480 Sin embargo, la validez de los datos debe evaluarse antes de su uso.481,482 Los sistemas de retroalimentación tienen un efecto positivo en la calidad de la atención y el personal médico está dispuesto a recibir comentarios.483,484 Una revisión sistemática reciente mostró mejoras en la documentación, la adherencia del protocolo y pequeños efectos en el rendimiento del paro cardíaco, la toma de decisiones clínicas, los tiempos de ambulancia y las tasas de supervivencia.485
Reanimación durante el transporte
La calidad de la RCP se reduce si se realiza durante el transporte, afectando la posición correcta de la mano, la tasa y profundidad de las compresiones torácicas, las pausas y la calidad general de la RCP.201,486 Solo unas pocas indicaciones justifican la reanimación continua durante el transporte (las intervenciones avanzadas no están disponibles en el entorno prehospitalario como se describe en este capítulo). Siempre que sea posible, se debe implementar una RCP mecánica para mitigar el riesgo tanto para el paciente como para el rescatador.
Línea arterial en el entorno prehospitalario
La medición invasiva de la presión arterial en pacientes con OHCA en una situación de HEMS es factible,383,487-491 y puede ayudar a los equipos prehospitalarios a guiar la reanimación y la atención posterior a la reanimación,383,487,489,492 específicamente en pacientes hemodinámicamente inestables.493,494
Reanimación por tripulaciones de ALS de dos miembros
Los equipos de más de dos miembros de ELA mejoran la calidad y la eficiencia de la RCP en el reconocimiento del ritmo, la administración de adrenalina y la intubación.495 No se encontraron diferencias significativas de fracción de no flujo entre los equipos de dos, tres y cuatro miembros.495 Los equipos de dos paramédicos eran más lentos y más propensos a errores que los equipos de técnicos médicos de emergencia paramédicos.495 La evidencia no es lo suficientemente sólida como para respaldar las recomendaciones formales para la educación, los protocolos o el equipo con respecto a la ELA proporcionados por dos HCP. Sin embargo, los estudios sugieren que las jeringas precargadas y los protocolos asistidos por automatización podrían mejorar el rendimiento del equipo.495
Paro cardíaco a bordo y reanimación por microgravedad
Paro cardíaco a bordo
Aunque los viajes aéreos son seguros en general, los cambios fisiológicos durante los viajes aéreos, la demografía de los pasajeros, las condiciones médicas preexistentes y el número de pasajeros a bordo de aeronaves más grandes y vuelos de larga distancia aumentan la probabilidad de emergencias en vuelo.496,497 Un metaanálisis informó de una incidencia de 0,09 eventos de paro cardíaco por millón de pasajeros.498 No todas las aerolíneas están equipadas con un equipo AED y ALS.499–501Se debe buscar ayuda profesional médica a través de un anuncio en vuelo. El rescatador debe arrodillarse en el espacio para las piernas frente a los asientos del pasillo para realizar compresiones torácicas si el paciente no puede ser transferido en pocos segundos a un área con espacio adecuado (por ejemplo, galera). La RCP aérea es una opción posible en entornos de espacio limitado. La gestión de las vías respiratorias debe basarse en el equipo disponible y en la experiencia del rescatista. Si el plan de vuelo es sobre aguas abiertas, con alta posibilidad de ROSC durante una reanimación en curso, considere una desviación temprana. Si el ROSC es poco probable (condiciones preexistentes, ausencia de un DEA), el tiempo esperado para el desvío y el aterrizaje sería demasiado largo para mejorar el pronóstico razonablemente.
Reanimación por microgravedad
La RCP es un desafío incluso para los profesionales capacitados en la tierra, y el vuelo espacial agrega más complicaciones debido a la microgravedad, el espacio confinado y los recursos limitados. Con el auge de las misiones comerciales por parte de empresas privadas, son esenciales directrices claras para gestionar emergencias médicas tanto en misiones espaciales de larga duración como a corto plazo.Existen recomendaciones de la Sociedad Alemana de Medicina Aeroespacial y del Grupo de Medicina Espacial de la Sociedad Europea de Medicina Aeroespacial.502 Sin embargo, un estudio de simulación reciente503 utilizando métodos submarinos para aproximar la microgravedad encontró que todas las técnicas de RCP comúnmente recomendadas504 (incluyendo Reverse-Bear Hug, Schmitz Hinkelbein, Cologne y Evetts-Russomano) dieron como resultado tasas inferiores al 5 % de compresiones torácicas efectivas. En ausencia de datos del entorno espacial real, no es posible respaldar ningún método de RCP en particular.Las recomendaciones clave del ERC se resumen aquí•El manejo de las vías respiratorias, la desfibrilación y el acceso IV/IO son similares a la ELA terrestre, pero solo una vez que el paciente está asegurado.•Considere la RCP mecánica•Consulte el soporte de telemedicina durante el paro cardíaco en órbita terrestre baja si es posible y la mano de obra lo permite.•El miembro de la tripulación con la calificación médica más alta debe decidir sobre la terminación de la reanimación, consultando el soporte de telemedicina.
Cruceros
Hay pocas pruebas sobre el tratamiento de la OHCA en los cruceros. Las directrices del ERC recomiendan adherirse a los protocolos estándar de BLS y ALS. Se espera que el resultado del paro cardíaco en los cruceros sea peor, en comparación con la población general, porque el acceso a las instalaciones de atención médica es más complicado, los recursos a bordo son limitados y las transferencias pueden prolongarse.505 Un equipo médico de primeros auxilios debe estar disponible las 24 horas del día, los 7 días de la semana. Todo el equipo necesario para la ALS debe estar disponible a bordo y de fácil acceso. Un DEA debe estar a bordo y solicitado de inmediato. Cuando hay muy pocos profesionales de la salud de la tripulación, se debe hacer un anuncio a bordo para pedir más ayuda médica profesional. En la mayoría de los cruceros, la telemedicina está disponible, y debe usarse lo antes posible.506 El transporte aéreo médico calificado es una opción para cubrir largas distancias a las instalaciones médicas.
Grupos especiales de pacientes
Asma y enfermedad pulmonar obstructiva crónica
Las recomendaciones basadas en la evidencia para el manejo del asma aguda que amenaza la vida se basan en la Sociedad Torácica Británica, la Red Intercolegial de Directrices Escocesas507 y la Iniciativa Global para la Estrategia de Asma 2021,508, mientras que para la enfermedad pulmonar obstructiva crónica (EPOC) las recomendaciones se basan en las de la iniciativa global para la enfermedad pulmonar obstructiva crónica.509 Una reciente actualización de evidencia de ILCOR8 no reveló ningún dato nuevo sobre el manejo del paro cardíaco en pacientes con asma más allá de las directrices del ERC de 2021.Los pacientes con una exacerbación de la enfermedad pulmonar obstructiva (asma/EPOC) tienen un alto riesgo de paro cardíaco.Para la EPOC, las directrices de la iniciativa mundial para la enfermedad pulmonar obstructiva crónica recomiendan que el oxígeno suplementario se titule para lograr una saturación objetivo del 88-92 %, con un monitoreo frecuente de los gases en sangre para garantizar una oxigenación adecuada sin retención de dióxido de carbono. La terapia farmacológica comprende agonistas beta-2 de acción corta inhalados con o sin anticolinérgicos de acción corta (con dosis repetidas según sea necesario), corticosteroides sistémicos y, en caso de sospecha de una infección bacteriana, antibióticos. Se recomienda la ventilación no invasiva en presencia de acidosis respiratoria (PaCO2 > 6 kPa/45 mmHg y pH arterial ≤ 7,35); disnea severa con signos clínicos de fatiga o aumento del trabajo respiratorio. La escalada a la ventilación invasiva puede ser necesaria si la VNI falla, si el paciente no puede tolerar la VNI, o hay factores como agitación, conciencia reducida, alto riesgo de aspiración, inestabilidad cardiovascular o hipoxia potencialmente mortal. Sin embargo, esté atento al mayor riesgo de hipotensión potencialmente mortal después de la intubación de emergencia y la ventilación mecánica en pacientes con CO2arterial elevado y enfermedad pulmonar obstructiva.510,511 En casos inconscientes seleccionados con hipoxemia grave, la ECMO veno-venosa puede ser una opción para prevenir el paro cardíaco hipóxico.512,513
Tratamiento del paro cardíaco causado por una enfermedad pulmonar obstructiva
El paro cardíaco en pacientes con enfermedad pulmonar obstructiva puede ser causado por hipoxia, hipovolemia, agentes tóxicos (arritmias causadas por medicamentos estimulantes, por ejemplo, agonistas beta-adrenérgicos, aminofilina), alteración electrolítica (hipotasemia), neumotórax por tensión y/o los efectos de la trampa de gas que conducen a una reducción del retorno venoso e hipotensión.514-519 El paro cardíaco en la enfermedad pulmonar obstructiva generalmente se asocia con un ritmo no shockable y malas tasas de supervivencia.520,521Debido a la presión de inflado extremadamente elevada durante los ataques de asma severos, existe un riesgo significativo de inflación y aspiración gástrica con hipoventilación simultánea de los pulmones cuando se intenta ventilar a un paciente asmático grave con dispositivos de máscara de válvula de bolsa. La tráquea debe ser intubada lo antes posible durante un paro cardíaco causado por el asma, por alguien que esté capacitado y sea competente para hacerlo.El neumotórax por tensión puede desarrollarse debido a la alta presión en las vías respiratorias, que, si no se trata, puede causar un paro cardíaco. Compruebe si hay signos de neumotórax por tensión y trate en consecuencia.522,523 Desconecte de la ventilación de presión positiva si se produce atrapación de aire e hiperinflación y aplique presión para reducir manualmente la hiperinflación. Algunos informes de casos han descrito ROSC en pacientes con atrapamiento de aire cuando el tubo traqueal se desconectó del sistema respiratorio.524–530 Si se sospecha de hiperinflación dinámica de los pulmones durante la RCP, la compresión del tórax mientras se desconecta temporalmente el tubo traqueal puede aliviar la captura de aire.524,527,529 Aunque este procedimiento está respaldado por pruebas limitadas, es poco probable que sea dañino en una situación por lo demás desesperada.La ventilación de los pulmones con una frecuencia respiratoria más lenta de 8-10 respiraciones por minuto y suficiente volumen corriente para hacer que el pecho se levante durante la RCP debe minimizar la hiperinflación dinámica de los pulmones (atrapa de aire).528 En pacientes ventilados mecánicamente con asma grave, aumentar el tiempo espiratorio (logrado reduciendo la frecuencia respiratoria y cambiando la relación de inspiración a la relación de espiración) proporciona solo ganancias moderadas en términos de reducción de atrapamiento de gas cuando se utiliza un volumen minuto de menos de 10 L min-1.531No se identificaron estudios que evaluaran el uso de fluidos intravenosos para el paro cardíaco causado por la enfermedad pulmonar obstructiva. Considere administrar líquidos intravenosos a pacientes con enfermedad pulmonar obstructiva, particularmente aquellos con una exacerbación aguda del asma, porque están deshidratados como resultado de la reducción de la ingesta oral y/o el aumento de las pérdidas insensibles. Dar líquidos con precaución para evitar posibles efectos adversos.532La ECPR se ha utilizado con éxito en pacientes con asma que amenaza la vida.513,533 De acuerdo con las Directrices ERC 2025 ALS, la ECPR puede considerarse si las terapias convencionales fallan y hay acceso inmediato a este tratamiento.
Paro cardíaco en pacientes con hemodiálisis
La enfermedad renal crónica es un problema de salud mundial que afecta a 1 de cada 10 personas en todo el mundo534 y la OMS proyecta que se convertirá en la quinta condición crónica más frecuente para 2040.535Los factores de riesgo para el paro cardíaco en pacientes con diálisis se resumen en la Tabla 10. Los trastornos de fluidos y electrolitos son comunes, y el período de mayor riesgo es justo antes de la primera sesión de diálisis de la semana, es decir, los lunes o martes. 536-540 El período de riesgo se extiende más de las 12 horas después del inicio del tratamiento. Esto sugiere que la rápida eliminación no fisiológica de toxinas, líquidos y electrolitos, más pronunciada durante la primera sesión de la semana, explica el período de alto riesgo.541,542 Las arritmias clínicamente significativas también son más comunes en diálisis en comparación con los días sin diálisis.543
La diálisis en el centro se administra 3 días a la semana (lunes / miércoles / viernes o martes / jueves / sábado)
El período de mayor riesgo es justo antes de la primera sesión de la semana (es decir, Lunes o martes) a medida que el nivel de K+ alcanza su punto máximo y el líquido se acumula
El riesgo se extiende durante 12 horas después del inicio de la diálisis en la primera sesión de la semana después de cambios rápidos de fluidos y electrolitos desde los niveles máximos
Líquido de dializado de potasio bajo (1 mmol L-1)
Antecedentes de enfermedades cardíacas
Medicamentos para prolongar el intervalo QT
Incumplimiento de la dieta y/o el régimen de diálisis
Reanimación en pacientes obesos
La obesidad es definida por la OMS como un índice de masa corporal que supera los 30 kg m−2.562 La obesidad puede aumentar la morbilidad y mortalidad cardiovascular directa e indirectamente.563 Dado el aumento global de la obesidad, una revisión de alcance de ILCOR evaluó la evidencia para el tratamiento y los resultados del paro cardíaco en pacientes obesos.564 En los adultos, el efecto de la obesidad en el resultado neurológico, la supervivencia al alta hospitalaria, la supervivencia a largo plazo (meses a años) y el ROSC fue variable. Pocos estudios informaron de indicadores de calidad de reanimación, y ningún estudio informó de ajustes a las técnicas de reanimación o resultados del proveedor. La evidencia actual indica que es razonable utilizar protocolos de reanimación estándar.La administración de RCP efectiva puede ser difícil en pacientes obesos.564 La fatiga del rescatador puede hacer que sea aconsejable cambiar al rescatador que realiza compresiones torácicas más a menudo que cada dos minutos. Se podría considerar el uso de dispositivos mecánicos de compresión torácica, aunque las dimensiones corporales y la pendiente de la pared torácica anterior limitan la usabilidad de la mayoría de los dispositivos en pacientes muy obesos. La obesidad se asocia con la difícil ventilación de la máscara y puede plantear dificultades con el manejo de las vías respiratorias.565,566 Los proveedores experimentados deben asegurar una vía aérea patente (dispositivos de las vías respiratorias supraglóticas o intubación traqueal) temprano para minimizar el período de ventilación con mascarilla. Aunque la mortalidad parece ser más alta en pacientes obesos que en pacientes de peso normal que reciben ECPR, no debe retenerse en pacientes obesos.567
Reanimación en pacientes con pectus excavatum
Esta deformación de la pared torácica (a veces asociada con cardiopatía congénita) reduce el espacio disponible para el corazón y los pulmones con presión directa a estos órganos y aumenta el riesgo de paro cardíaco.568 El corazón a menudo se desplaza hacia la izquierda, lo que puede complicar las compresiones torácicas efectivas. Los informes sugieren una reducción de la profundidad de compresión torácica (3–4 cm) para minimizar el riesgo de lesión orgánica en presencia de un diámetro torácico anteroposterior reducido.569,570Las «barras de nuez» correctivas colocadas quirúrgicamente complican la RCP, ya que requieren una fuerza significativamente mayor para ofrecer una profundidad de compresión torácica adecuada.571 La fatiga del rescatador y el daño a los órganos (específicamente laseraciones hepáticas) deben considerarse cuando se administran compresiones torácicas mecánicas.572 La desfibrilación en presencia de una barra de Nuss puede desviar el flujo de corriente eléctrica a través de la barra metálica de baja resistencia cuando se colocan las almohadillas de desfibrilación anterolateralmente.573Basado en datos muy indirectos de informes de casos, estudios anatómicos y de simulación que reportan un paro cardíaco en pacientes con pectus excavatum, se podrían considerar las siguientes desviaciones del algoritmo estándar:•Durante la RCP, considere una profundidad de compresión torácica inferior de 3-4 cm, porque el diámetro torácico anteroposterior reducido limita la profundidad de compresión efectiva alcanzable y aumenta el riesgo de trauma directo al corazón, los pulmones y los grandes vasos.•En el caso de una corrección de la barra de Nuss, se requiere una fuerza sustancialmente mayor para ofrecer compresiones torácicas efectivas debido al aumento de la rigidez de la pared torácica, lo que potencialmente acelera la fatiga del rescatador.•Utilice las compresiones torácicas mecánicas con precaución.•Si las compresiones torácicas son ineficaces, considere la implementación temprana de la RCP para garantizar una perfusión orgánica suficiente.•Utilice la colocación de la almohadilla anteroposterior para la desfibrilación utilizando energías estándar para garantizar un flujo de corriente óptimo a través del miocardio, a pesar de la presencia de la barra metálica Nuss.574
Paro cardíaco durante el embarazo
El paro cardíaco materno se refiere al paro cardíaco que ocurre en cualquier etapa del embarazo o dentro de las seis semanas posteriores al nacimiento. La mortalidad materna sigue siendo alta, con un estimado de 287.000 casos en todo el mundo en 2020, lo que equivale a una muerte cada dos minutos. La mayoría se encuentra en países de ingresos bajos y medianos. Una proporción significativa de los paros cardíacos maternos ocurren fuera de las unidades de maternidad. El embarazo no siempre es evidente de inmediato, particularmente en sus primeras etapas. Sin embargo, considerar el embarazo en pacientes en edad reproductiva es esencial para identificar causas reversibles como el sangrado ectópico oculto y factores modificables como la compresión aortocaval después de 20 semanas de gestación.575Estas Directrices han sido informadas por una revisión de alcance de ILCOR334 y directrices internacionales.575–583 La mayoría de las directrices se basan en datos de observación, opinión de expertos y principios fisiológicos. Esta actualización introduce un nuevo proceso para el manejo del paro cardíaco materno junto con cifras y tablas clave para apoyar la aplicación clínica.Los datos estadounidenses revelan que el 32 % de los pacientes obstétricos que experimentan paro cardíaco no tienen antecedentes de un trastorno preexistente, el 36,1 % tenía insuficiencia respiratoria, mientras que el 33,3 % tenía hipotensión como las condiciones antecedentes más comunes. La actividad eléctrica sin pulsos es el ritmo más común.584 Si bien hay datos limitados sobre las causas precisas de paro cardíaco materno, MBRACE-UK informa que las causas de mortalidad materna de 2020 a 2022 son tromboembolismo (16 %), COVID-19 (14 %), enfermedad cardíaca (13 %), afecciones de salud mental (11 %), sepsis (9 %), epilepsia y accidente cerebrovascular (9 %), sangrado obstétrico (7 %), trastornos del embarazo temprano (5 %), cáncer (3 %), y preeclampsia (3 %). Los factores de riesgo incluyeron la etnia negra y asiática, la privación social, la edad materna > 35 años y la obesidad.575 Por el contrario, los datos globales de países de bajos y medianos ingresos identificaron la hemorragia (27,1 %), los trastornos hipertensivos (14 %) y la sepsis (10,7 %) como las principales causas directas de muerte materna.585El Sistema de Vigilancia Obstétrica del Reino Unido identificó 66 casos de paro cardíaco en el embarazo en un período de tres años con una tasa de supervivencia del 58 %, malos resultados relacionados con la OHCA y retrasos en la histerotomía de reanimación.586 La encuesta NAP7 del Reino Unido informó una incidencia de paro cardíaco perioperatorio en pacientes obstétricas de 7,9 por cada 100.000 encuentros anestésicos y una tasa de supervivencia del 82 %, con hemorragia, bloqueo neuroaxial alto y bradiritmias como las principales causas.587
Prevención del paro cardíaco materno
El paro cardíaco materno generalmente es prevenible, aunque en ciertas causas, como la embolia del líquido amniótico, el paro puede ocurrir antes de la intervención.588 Acérquese a cualquier paciente embarazada o periparto que se deteriore siguiendo el enfoque ABCDE. Hay pruebas que sugieren que la implementación de un sistema de alerta temprana específico para la obstetricia permite el reconocimiento temprano de las pacientes embarazadas que se deterioran; sin embargo, la absorción en toda Europa es baja.589-593 La participación temprana de un obstetra, junto con la activación simultánea de los equipos de reanimación materna y neonatal, es esencial.
Compresión aortocaval
La compresión aortocaval (es decir, la compresión de la vena cava inferior y la aorta por el útero gravido) generalmente se manifiesta en la semana 20 de gestación. Esto puede reducir significativamente el retorno venoso y, posteriormente, el gasto cardíaco en posición supina.594,595 En pacientes embarazadas sanas con mecanismos compensatorios intrínsecos preservados, los efectos de la compresión aortocaval pueden estar ausentes o mínimos.596 Sin embargo, en pacientes críticamente enfermos o hipotensos, la compresión aortocaval puede precipitar el paro cardíaco y limitar la eficacia de la reanimación cardiopulmonar.La compresión aortocaval puede aliviarse mediante el desplazamiento uterino izquierdo manual o la inclinación lateral izquierda (Fig. 19), aunque los datos de apoyo se derivan de estudios de simulación y de arresto no cardíaco. ILCOR realizó una revisión de alcance sobre este tema y encontró evidencia insuficiente para recomendar cualquiera de los dos métodos sobre el otro durante la RCP en pacientes embarazadas.8 Las imágenes de resonancia magnética sugieren que se necesita una inclinación lateral izquierda de aproximadamente 30° para aliviar parcialmente la compresión de la vena cava inferior. Esto se puede lograr aplicando inclinación lateral en una mesa de operaciones o colocando cuñas debajo de la cadera derecha para los pacientes en una cama convencional.597-599 Sin embargo, las cuñas rara vez están disponibles, y la simulación y los estudios con animales han cuestionado la efectividad de las compresiones torácicas en la posición lateral izquierda.600,601
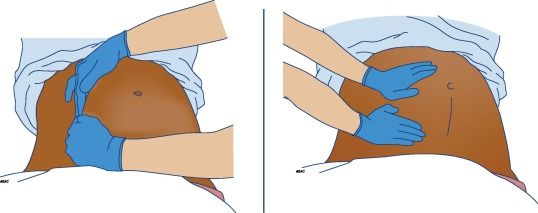
En consecuencia, el ERC sugiere realizar un desplazamiento uterino izquierdo manual en el paro cardíaco materno. Se puede lograr colocando una o ambas manos debajo del útero, en el lado derecho del paciente, y empujando hacia arriba y hacia la izquierda, o si está de pie a la izquierda del paciente, alcanzando para ahuecar el útero desde abajo y levantándolo hacia arriba y hacia la izquierda (Fig. 19).602.603El alivio definitivo de la compresión aortocaval solo se puede lograr mediante histerotomía de reanimación (a veces conocida como «sección cesárea perimortem»).
Histerotomía de reanimación
La histerotomía de reanimación debe ser realizada por un equipo calificado en el sitio del paro cardíaco para lograr ROSC aliviando la compresión aortocaval.604 Las pautas anteriores recomendaban comenzar el procedimiento a los 4 minutos y completar la evacuación uterina en 5 minutos.605 El suplemento de paro cardíaco materno al algoritmo de ELA (Tabla 12) cambia el enfoque a la preparación para la histerotomía de reanimación, destacando la naturaleza sensible al tiempo de la intervención.•La revisión de ILCOR encontró pruebas insuficientes para apoyar un tiempo específico para iniciar la histerotomía de reanimación.•La histerotomía de reanimación sensible al tiempo depende de las competencias del equipo claramente designadas, la rápida activación del sistema y la preparación del equipo, todo lo que requiere entrenamiento y ensayo.606,607•Si la detención es el resultado de hipotensión a pesar de la reanimación óptima, se sugiere que se realice una histerotomía de reanimación lo antes posible.•El procedimiento no debe considerarse inútil más allá de 5 minutos, sin embargo, el beneficio disminuye constantemente cuanto más tiempo se retrasa el vaciado del útero.586,608•En casos excepcionales, la ECPR puede iniciarse de inmediato, con la evacuación uterina pospuesta debido a los riesgos de sangrado relacionados con la anticoagulación.609,610•En el entorno prehospitalario, el procedimiento requiere un acceso adecuado al paciente y a un médico capacitado, de lo contrario, priorizar el transporte de tiempo crítico al hospital
Si bien el tiempo fijo para la histerotomía de reanimación no se hace enfatisis, la intervención temprana sigue siendo primordial para maximizar la posibilidad de retorno de la circulación espontánea y reducir el riesgo de lesión cerebral hipóxica.
Soporte vital extracorpóreo
Un análisis retrospectivo de pacientes periparto que requieren ECPR del Registro Internacional de la Organización de Soporte Vital Extracorpóreo, identificó a 280 pacientes,611 con una supervivencia del 70 %. Las tasas de supervivencia fueron más altas cuando se inició la oxigenación membranosa extracorpórea (ECMO) antes del paro cardíaco.Si está disponible, el equipo multidisciplinario puede considerar la ECMO temprana en pacientes embarazadas con signos de colapso circulatorio inminente.
Alivia la compresión aortocaval
La compresión aortocaval debe aliviarse lo antes posible y mantenerse a lo largo de la reanimación (Fig. 19).
Compresiones torácicas
Actualmente, no hay pruebas sólidas que respalden la modificación de la posición de la mano para las compresiones torácicas durante el embarazo. Un estudio de resonancia magnética de la remodelación cardíaca en el tercer trimestre del embarazo mostró un aumento en la masa ventricular izquierda, pero sin desplazamiento de la cefalada.612 Sin embargo, un estudio posterior de ecocardiografía transtorácica de la posición ventricular izquierda durante el tercer trimestre demostró que se encuentra aproximadamente a 6 cm craneal de la punta distal del proceso xifoideo.613Con respecto a los dispositivos mecánicos de compresión torácica, no hay pruebas suficientes para hacer una recomendación a favor o en contra de su uso, aunque en ciertos escenarios, las alternativas prácticas no están disponibles, por ejemplo, durante la extricación o el transporte en el entorno prehospitalario.614
Gestión de las vías respiratorias
El embarazo aumenta el riesgo de aspiración del contenido gástrico y la intubación difícil.615-617 Maneje las vías respiratorias según lo indicado por las Directrices ERC 2025 ALS (máscara de bolsa, tubo traqueal o vía aérea supraglótica si la intubación traqueal falla) de acuerdo con las habilidades del HCP. La intubación traqueal temprana facilita la oxigenación y la ventilación, al tiempo que protege contra la aspiración, pero se considera una habilidad experta y debe realizarse de acuerdo con las pautas actuales de anestesia obstétrica.617
Desfibrilación
Cuando use el posicionamiento anterolateral, asegúrese de que las almohadillas de desfibrilación se coloquen debajo, no sobre, el tejido mamario agrandado. Los niveles de energía de desfibrilación son los mismos que los de los adultos no embarazadas.618 Para evitar quemaduras, se debe eliminar el monitoreo fetal externo antes de la desfibrilación.
Medicación
Los medicamentos utilizados en la reanimación de mujeres embarazadas son los mismos que para la población adulta en general. Si bien hay evidencia limitada, el acceso intravenoso o intraóseo debe establecerse por encima del nivel del diafragma siempre que sea posible, según consideraciones fisiológicas.619
Causas reversibles
Las 4H y 4T son consideraciones importantes en todos los paros cardíacos, incluso durante el embarazo, y pueden provocar diagnósticos específicos del embarazo, como hipovolemia por un embarazo ectópico roto o embolia pulmonar, siendo esta última más común en mujeres embarazadas y posparto (Tabla 13). Sin embargo, también hay causas específicas del embarazo de paro cardíaco, que ahora se introducen como las 4P:
Preeclampsia y eclampsia: Siga las pautas establecidas para el manejo.620 Inicie el tratamiento inmediato para la hipertensión grave, definido como ≥ 160/110 mmHg. En casos graves, dar 4 g de sulfato de magnesio IV durante 5 a 15 minutos para tratar y prevenir la eclampsia, seguido de 1 g/h durante 24 h.620 Considere el edema pulmonar y trate en consecuencia. La toxicidad del magnesio por sobredosis de tratamiento puede causar paro cardíaco
epsis puerperal: En caso de sospecha de sepsis puerperal, tome hemocultivos, administre antibióticos de amplio espectro tempranos y considere fuentes obstétricas como corioamnionitis, productos retenidos, endometriosis o infección del sitio quirúrgico que pueda requerir intervención.Complicaciones placentarias y uterinas: Los ejemplos incluyen abrupción placentaria, placenta previa o acreta, atonía uterina, ruptura, inversión y embolia de líquido amniótico. Busque signos clínicos de hemorragia abierta u oculta (vaginal o intraabdominal). Examine el abdomen en busca de peritonismo y líquido libre (use ultrasonido si está disponible), evalúe la hipovolemia, verifique la concentración de hemoglobina y evalúe la función de la coagulación. Solicite productos sanguíneos, avise al equipo obstétrico y prepárese para una intervención quirúrgica urgente. El manejo de la embolia de líquido amniótico es de apoyo: mantener la oxigenación, tratar la hemorragia con hemoderivos, corregir la coagulación intravascular diseminada (CID) e involucrar inmediatamente a los equipos de obstetricia, anestésicos y de cuidados intensivos.Miocardiopatía periparto: Tratar como insuficiencia cardíaca aguda. Considere los diuréticos intravenosos, vasodilatadores (por ejemplo, nitratos) e inotrópicos si está indicado. Evite la sobrecarga de líquidos. Busque información temprana sobre ecocardiografía y cardiología.
Enfermedad cardiovascular
La intervención coronaria percutánea es la estrategia de reperfusión preferida para el IAMCEST en el embarazo.582 Considere la trombólisis si la ICP oportuna no está disponible. Una revisión de 200 casos de trombólisis para embolia pulmonar masiva en el embarazo informó que la tasa de mortalidad materna del 1 % respalda su uso seguro durante el embarazo cuando está clínicamente indicado.621 La ecografía en el punto de atención es invaluable en los casos en que no está claro si la causa de la detención se debe a una hemorragia oculta o tromboembolismo.575
Hemorragia
Esta es una de las principales causas de morbilidad y mortalidad materna.622 La hemorragia potencialmente mortal puede ocurrir tanto prenatal como postnatal. Asegúrese de que un protocolo de hemorragia obstétrica masiva/mayor esté disponible en todas las unidades, y que se revise regularmente y se ensaye en colaboración con todos los miembros del equipo, incluidos los servicios de transfusión y el personal de portero.623La gestión incluye:•Participación inmediata de los equipos obstétricos, anestésicos y de cuidados intensivos que deben seguir las directrices existentes para el manejo de la hemorragia obstétrica mayor.623,624•Activación del protocolo de hemorragia obstétrica mayor, con rápida transfusión de sangre y corrección de la coagulopatía.•Administración de ácido tranexámico 1 g IV en casos de sospecha de sangrado.625–628
Consideraciones maternas para la atención posterior a la reanimación
La atención posterior a la reanimación durante el embarazo se alinea con el manejo estándar de adultos, con algunas consideraciones adicionales importantes. Se ha informado de control de temperatura hipotérmico en casos aislados durante el embarazo temprano, con monitoreo de la frecuencia cardíaca fetal establecido. No hubo evidencia de daño y los resultados maternos y neonatales fueron favorables.629,630 El enfoque continuo debería ser reanimar a la madre. Una vez que la madre esté estabilizada, también se optimizará la reanimación fetal. Esto incluye el tratamiento de la patología materna, la optimización de la fisiología materna y la garantía de las investigaciones e imágenes necesarias. La preparación para la hemorragia obstétrica mayor en previsión de ROSC es esencial después de la histerotomía o trombólisis de reanimación, así como para otras causas de paro cardíaco materno como la embolia de líquido amniótico.La enfermedad crítica materna requiere un enfoque multidisciplinario, por lo que es esencial involucrar a todas las especialidades relevantes, incluyendo obstetricia, anestesia, cuidados intensivos y neonatología.631Se debe reconocer el impacto psicológico de los resultados maternos adversos, con apoyo ofrecido al paciente, a su familia y al personal involucrado en su atención.
Preparación para el paro cardíaco durante el embarazo
Las brechas en la preparación, incluida la disponibilidad de equipos y la coordinación multidisciplinaria, siguen siendo generalizadas y pueden obstaculizar el soporte vital avanzado en el embarazo, incluida la histerotomía de reanimación sensible al tiempo y la reanimación neonatal.593Las mujeres embarazadas y periparto pueden deteriorarse a un paro cardíaco en cualquier lugar y las instalaciones y servicios médicos deben estar preparados para tales eventos. Debería haber 632–638:•Planes y equipos para la reanimación tanto de la mujer embarazada como del recién nacido (ver Tabla 14).•Participación temprana de los equipos obstétricos, anestésicos, de cuidados intensivos y neonatales.•Entrenamiento multidisciplinario regular en emergencias obstétricas, utilizando escenarios de reanimación simulados.•Revisión y presentación posterior a los eventos clínicos para apoyar el aprendizaje y el rendimiento del equipo
References
1.Berg, K.M. ∙ Bray, J.E. ∙ Djarv, T. …Executive Summary: 2025 International Liaison Committee on Resuscitation Consensus on Science With Treatment RecommendationsResuscitation. 2025; 215, 110805Google Scholar2.Greif, R.L.K.G. ∙ Djärv, T. ∙ Ek, J.E. …European resuscitation council guidelines 2025: executive summaryResuscitation. 2025; 215, 110770Google Scholar3.Djärv, T.R.J. ∙ Semeraro, F. ∙ Brädde, L. …European Resuscitation Council Guidelines 2025: First AidResuscitation. 2025; 215, 110752Google Scholar4.Panesar, S.S. ∙ Javad, S. ∙ de Silva, D. …The epidemiology of anaphylaxis in Europe: a systematic reviewAllergy. 2013; 68:1353-1361Google Scholar5.Aurich, S. ∙ Dölle-Bierke, S. ∙ Francuzik, W. …Anaphylaxis in elderly patients—data from the European Anaphylaxis RegistryFront Immunol. 2019; 10:750Google Scholar6.Francuzik, W. ∙ Ruëff, F. ∙ Bauer, A. …Phenotype and risk factors of venom-induced anaphylaxis: a case-control study of the European Anaphylaxis RegistryJ Allergy Clin Immunol. 2021; 147:653-662.e9Google Scholar7.Turner, P.J. ∙ Gowland, M.H. ∙ Sharma, V. …Increase in anaphylaxis-related hospitalizations but no increase in fatalities: an analysis of United Kingdom national anaphylaxis data, 1992-2012J Allergy Clin Immunol. 2015; 135:956-963.e1Google Scholar8.Greif, R. ∙ Bray, J.E. ∙ Djärv, T. …2024 international consensus on cardiopulmonary resuscitation and emergency cardiovascular care science with treatment recommendations: summary from the basic life support; advanced life support; pediatric life support; neonatal life support; education, implementation, and teams; and first aid task forcesResuscitation. 2024; 205Google Scholar9.Cardona, V. ∙ Ansotegui, I.J. ∙ Ebisawa, M. …World allergy organization anaphylaxis guidance 2020World Allergy Organ J. 2020; 13, 100472Google Scholar10.Muraro, A. ∙ Worm, M. ∙ Alviani, C. …EAACI guidelines: anaphylaxis (2021 update)Allergy. 2022; 77:357-377Google Scholar11.Golden, D.B.K. ∙ Wang, J. ∙ Waserman, S. …Anaphylaxis: a 2023 practice parameter updateAnn Allergy Asthma Immunol. 2024; 132:124-176Google Scholar12.(ASCIA) ASoCIaA. Australasian Society of Clinical Immunology and Allergy (ASCIA). (https://www.allergy.org.au/images/ASCIA_HP_Guidelines_Acute_Management_Anaphylaxis_2024.pdf).Google Scholar13.Cook, T.M. ∙ Kane, A.D. ∙ Armstrong, R.A. …Peri-operative cardiac arrest due to suspected anaphylaxis as reported to the 7th national audit project of the royal college of anaesthetistsAnaesthesia. 2024; 79:498-505Google Scholar14.Brown, S.G.A.Cardiovascular aspects of anaphylaxis: implications for treatment and diagnosisCurrent Opinion in Allergy and Clinical Immunology. 2005; 5:359-364Google Scholar15.Pumphrey, R.S.Fatal posture in anaphylactic shockJ Allergy Clin Immunol. 2003; 112:451-452Google Scholar16.Turner, P.J. ∙ Jerschow, E. ∙ Umasunthar, T. …Fatal anaphylaxis: mortality rate and risk factorsJ Allergy Clin Immunol Pract. 2017; 5:1169-1178Google Scholar17.Cardona, V. ∙ Ferré-Ybarz, L. ∙ Guilarte, M. …Safety of adrenaline use in anaphylaxis: a multicentre registerInt Arch Allergy Immunol. 2017; 173:171-177Google Scholar18.Simons, F.E. ∙ Gu, X. ∙ Simons, K.J.Epinephrine absorption in adults: intramuscular versus subcutaneous injectionJ Allergy Clin Immunol. 2001; 108:871-873Google Scholar19.Carlson, J.N. ∙ Cook, S. ∙ Djarv, T. …Second dose of epinephrine for anaphylaxis in the first aid setting: a scoping reviewCureus. 2020; 12, e11401Google Scholar20.Campbell, R.L. ∙ Bellolio, M.F. ∙ Knutson, B.D. …Epinephrine in anaphylaxis: higher risk of cardiovascular complications and overdose after administration of intravenous bolus epinephrine compared with intramuscular epinephrineJ Allergy Clin Immunol Pract. 2015; 3:76-80Google Scholar21.Ring, J. ∙ Beyer, K. ∙ Biedermann, T. …Guideline (S2k) on acute therapy and management of anaphylaxis: 2021 updateAllergo J Int. 2021; 30:1-25Google Scholar22.Boswell, B. ∙ Rudders, S.A. ∙ Brown, J.C.Emerging therapies in anaphylaxis: alternatives to intramuscular administration of epinephrineCurr Allergy Asthma Rep. 2021; 21:18Google Scholar23.Dewachter, P. ∙ Savic, L.Perioperative anaphylaxis: pathophysiology, clinical presentation and managementBJA Educ. 2019; 19:313-320Google Scholar24.Vincent, J.L. ∙ De Backer, D.Circulatory shockN Engl J Med. 2013; 369:1726-1734Google Scholar25.O’Driscoll, B.R. ∙ Howard, L.S. ∙ Earis, J. …BTS guideline for oxygen use in adults in healthcare and emergency settingsThorax. 2017; 72:ii1-ii90Google Scholar26.Ellis, B.C. ∙ Brown, S.G.Parenteral antihistamines cause hypotension in anaphylaxisEmerg Med Australas. 2013; 25:92-93Google Scholar27.Alqurashi, W. ∙ Ellis, A.K.Do corticosteroids prevent biphasic anaphylaxis?J Allergy Clin Immunol Pract. 2017; 5:1194-1205Google Scholar28.Liyanage, C.K. ∙ Galappatthy, P. ∙ Seneviratne, S.L.Corticosteroids in management of anaphylaxis; a systematic review of evidenceEur Ann Allergy Clin Immunol. 2017; 49:196-207Google Scholar29.Delli Colli, L. ∙ Al Ali, A. ∙ Gabrielli, S. …Managing anaphylaxis: epinephrine, antihistamines, and corticosteroids: more than 10 years of Cross-Canada Anaphylaxis REgistry dataAnn Allergy Asthma Immunol. 2023; 131:752-758.e1Google Scholar30.Gabrielli, S. ∙ Clarke, A. ∙ Morris, J. …Evaluation of prehospital management in a Canadian emergency department anaphylaxis cohortJ Allergy Clin Immunol Pract. 2019; 7:2232-2238.e3Google Scholar31.Tafesse, E. ∙ Hurst, M. ∙ Sugrue, D. …Serum potassium as a predictor of adverse clinical outcomes in patients with increasing comorbidity burdenEur Heart J Qual Care Clin Outcomes. 2022; 8:61-69Google Scholar32.Jessen, M.K. ∙ Andersen, L.W. ∙ Djakow, J. …Pharmacological interventions for the acute treatment of hyperkalaemia: a systematic review and meta-analysisResuscitation. 2025;, 110489Google Scholar33.Conway, R. ∙ Creagh, D. ∙ Byrne, D.G. …Serum potassium levels as an outcome determinant in acute medical admissionsClin Med (Lond). 2015; 15:239-243Google Scholar34.Einhorn, L.M. ∙ Zhan, M. ∙ Hsu, V.D. …The frequency of hyperkalemia and its significance in chronic kidney diseaseArch Intern Med. 2009; 169:1156-1162Google Scholar35.Yu, Y. ∙ Vangaveti, V.N. ∙ Schnetler, R.J. …Hyperkalaemia among hospital admissions: prevalence, risk factors, treatment and impact on length of stayBMC Nephrol. 2024; 25:454Google Scholar36.Agiro, A. ∙ Mu, F. ∙ Cook, E. …Hyperkalemia and the risks of adverse cardiovascular outcomes in patients with chronic kidney diseaseJ Am Heart Assoc. 2025; 14, e035256Google Scholar37.Logan Ellis, H. ∙ Al-Agil, M. ∙ Kelly, P.A. …The burden of hyperkalaemia on hospital healthcare resourcesClin Exp Med. 2024; 24:190Google Scholar38.Fu, E.L. ∙ Evans, M. ∙ Clase, C.M. …Stopping renin-angiotensin system inhibitors in patients with advanced CKD and risk of adverse outcomes: a nationwide studyJ Am Soc Nephrol. 2021; 32:424-435Google Scholar39.Svensson, M.K. ∙ Murohara, T. ∙ Lesen, E. …Hyperkalaemia-related reduction of RAASi treatment associates with more subsequent inpatient careNephrol Dial Transplant. 2024; 39:1258-1267Google Scholar40.Yang, A. ∙ Shi, M. ∙ Lau, E.S.H. …Clinical outcomes following discontinuation of renin-angiotensin-system inhibitors in patients with type 2 diabetes and advanced chronic kidney disease: a prospective cohort studyEClinicalMedicine. 2023; 55, 101751Google Scholar41.Kosiborod, M.N. ∙ Cherney, D.Z.I. ∙ Desai, A.S. …Sodium zirconium cyclosilicate for management of hyperkalemia during spironolactone optimization in patients with heart failureJ Am Coll Cardiol. 2024;Google Scholar42.Pitt, B. ∙ Anker, S.D. ∙ Lund, L.H. …Patiromer facilitates angiotensin inhibitor and mineralocorticoid antagonist therapies in patients with heart failure and hyperkalemiaJ Am Coll Cardiol. 2024; 84:1295-1308Google Scholar43.Chothia, M.Y. ∙ Kassum, P. ∙ Zemlin, A.A method comparison study of a point-of-care blood gas analyser with a laboratory auto-analyser for the determination of potassium concentrations during hyperkalaemia in patients with kidney diseaseBiochem Med (Zagreb). 2020; 30, 030702Google Scholar44.Ismail, M.H. ∙ Baharuddin, K.A. ∙ Suliman, M.A. …Hyperkalemia measurement between blood gas analyser and main laboratory biochemistry analyserMed J Malaysia. 2021; 76:157-163https://www.ncbi.nlm.nih.gov/pubmed/33742622Google Scholar45.Mahmoud, H. ∙ Jaffar, Z. ∙ Al Alawi, Y.M. …Accuracy of potassium measurement using blood gas analyzerCureus. 2022; 14, e23653Google Scholar46.Durfey, N. ∙ Lehnhof, B. ∙ Bergeson, A. …Severe hyperkalemia: can the electrocardiogram risk stratify for short-term adverse events?West J Emerg Med. 2017; 18:963-971Google Scholar47.Littmann, L. ∙ Gibbs, M.A.Electrocardiographic manifestations of severe hyperkalemiaJ Electrocardiol. 2018; 51:814-817Google Scholar48.Batterink, J. ∙ Cessford, T.A. ∙ Taylor, R.A.I.Pharmacological interventions for the acute management of hyperkalaemia in adultsCochrane Database of Systematic Reviews. 2015;Google Scholar49.Mahoney BA, Smith WAD, Lo DS, Tsoi K, Tonelli M, Clase CM. Emergency interventions for hyperkalaemia – art. no. CD003235.pub2. Cochrane Database of Systematic Reviews 2005(2) (In English). doi: ARTN CD003235. 10.1002/14651858.CD003235.pub2.Google Scholar50.Alfonzo, A. ∙ Harrison, A. ∙ Baines, R. …Treatment of acute hyperkalaemia in adultsUK Kidney Association (UKKA) Guideline. 2023;http://www.ukkidney.orgGoogle Scholar51.Cook, M.E. ∙ Tran, L.K. ∙ DeGrado, J.R. …Evaluation of insulin dosing strategies for hyperkalemia management at an academic medical centerClin Ther. 2024; 46:382-388Google Scholar52.Finder, S.N. ∙ McLaughlin, L.B. ∙ Dillon, R.C.5 versus 10 units of intravenous insulin for hyperkalemia in patients with moderate renal dysfunctionJ Emerg Med. 2022; 62:298-305Google Scholar53.Garcia, J. ∙ Pintens, M. ∙ Morris, A. …Reduced versus conventional dose insulin for hyperkalemia treatmentJ Pharm Pract. 2018;, 897190018799220Google Scholar54.Moussavi, K. ∙ Nguyen, L.T. ∙ Hua, H. …Comparison of IV insulin dosing strategies for hyperkalemia in the emergency departmentCrit Care Explor. 2020; 2, e0092Google Scholar55.Pearson, S.C. ∙ O’Connor, K. ∙ Keller, K. …Efficacy of standard- vs reduced-dose insulin for treatment of hyperkalemia: a quasi-experimentAm J Health Syst Pharm. 2022; 79:S13-S20Google Scholar56.Lim, A.K.H. ∙ Crnobrnja, L. ∙ Metlapalli, M. …The effect of patient factors and cotreatments on the magnitude of potassium lowering with insulin-glucose treatment in patients with hyperkalemiaEpidemiologia (Basel). 2021; 2:27-35Google Scholar57.Apel, J. ∙ Reutrakul, S. ∙ Baldwin, D.Hypoglycemia in the treatment of hyperkalemia with insulin in patients with end-stage renal diseaseClin Kidney J. 2014; 7:248-250Google Scholar58.Boughton, C.K. ∙ Dixon, D. ∙ Goble, E. …Preventing hypoglycemia following treatment of hyperkalemia in hospitalized patientsJ Hosp Med. 2019; 14:284-287Google Scholar59.Coca, A. ∙ Valencia, A.L. ∙ Bustamante, J. …Hypoglycemia following intravenous insulin plus glucose for hyperkalemia in patients with impaired renal functionPLoS One. 2017; 12, e0172961Google Scholar60.LaRue, H.A. ∙ Peksa, G.D. ∙ Shah, S.C.A comparison of insulin doses for the treatment of hyperkalemia in patients with renal insufficiencyPharmacotherapy. 2017; 37:1516-1522Google Scholar61.Pierce, D.A. ∙ Russell, G. ∙ Pirkle, Jr., J.L.Incidence of hypoglycemia in patients with low eGFR treated with insulin and dextrose for hyperkalemiaAnn Pharmacother. 2015; 49:1322-1326Google Scholar62.Scott, N.L. ∙ Klein, L.R. ∙ Cales, E. …Hypoglycemia as a complication of intravenous insulin to treat hyperkalemia in the emergency departmentAm J Emerg Med. 2019; 37:209-213Google Scholar63.Chothia, M.Y. ∙ Humphrey, T. ∙ Schoonees, A. …Hypoglycaemia due to insulin therapy for the management of hyperkalaemia in hospitalised adults: a scoping reviewPLoS One. 2022; 17, e0268395Google Scholar64.Crnobrnja, L. ∙ Metlapalli, M. ∙ Jiang, C. …The association of insulin-dextrose treatment with hypoglycemia in patients with hyperkalemiaSci Rep. 2020; 10:22044Google Scholar65.Humphrey, T.J.L. ∙ James, G. ∙ Wilkinson, I.B. …Clinical outcomes associated with the emergency treatment of hyperkalaemia with intravenous insulin-dextroseEur J Intern Med. 2022; 95:87-92Google Scholar66.Kijprasert, W. ∙ Tarudeeyathaworn, N. ∙ Loketkrawee, C. …Predicting hypoglycemia after treatment of hyperkalemia with insulin and glucose (Glu-K60 score)BMC Emerg Med. 2022; 22:179Google Scholar67.Tee, S.A. ∙ Devine, K. ∙ Potts, A. …Iatrogenic hypoglycaemia following glucose-insulin infusions for the treatment of hyperkalaemiaClin Endocrinol (Oxf). 2021; 94:176-182Google Scholar68.Ibarra, Jr., F. ∙ Fountain, C. ∙ Fallert, T.Current hyperkalemia interventions co-administered with a dextrose 10% solution significantly lower hypoglycemic rates (CHICA-D10)Am J Emerg Med. 2024; 84:120-123Google Scholar69.Allon, M. ∙ Copkney, C.Albuterol and insulin for treatment of hyperkalemia in hemodialysis patientsKidney International. 1990; 38:869-872Google Scholar70.Ahmed, J. ∙ Weisberg, L.S.Hyperkalemia in dialysis patientsSemin Dialysis. 2001; 14:348-356[In English]Google Scholar71.Vallentin, M.F. ∙ Granfeldt, A. ∙ Meilandt, C. …Effect of intravenous or intraosseous calcium vs saline on return of spontaneous circulation in adults with out-of-hospital cardiac arrest: a randomized clinical trialJAMA. 2021; 326:2268-2276Google Scholar72.Piktel, J.S. ∙ Wan, X. ∙ Kouk, S. …Beneficial effect of calcium treatment for hyperkalemia is not due to “membrane stabilization”Crit Care Med. 2024; 52:1499-1508Google Scholar73.Fishel Bartal, M. ∙ Sibai, B.M.Eclampsia in the 21st centuryAm J Obstet Gynecol. 2022; 226:S1237-S1253Google Scholar74.Kosiborod, M. ∙ Rasmussen, H.S. ∙ Lavin, P. …Effect of sodium zirconium cyclosilicate on potassium lowering for 28 days among outpatients with hyperkalemia: the HARMONIZE randomized clinical trialJAMA. 2014; 312:2223-2233Google Scholar75.Wallmuller, C. ∙ Meron, G. ∙ Kurkciyan, I. …Causes of in-hospital cardiac arrest and influence on outcomeResuscitation. 2012; 83:1206-1211Google Scholar76.Wang, C.H. ∙ Huang, C.H. ∙ Chang, W.T. …The effects of calcium and sodium bicarbonate on severe hyperkalaemia during cardiopulmonary resuscitation: a retrospective cohort study of adult in-hospital cardiac arrestResuscitation. 2016; 98:105-111Google Scholar77.Saarinen, S. ∙ Nurmi, J. ∙ Toivio, T. …Does appropriate treatment of the primary underlying cause of PEA during resuscitation improve patients’ survival?Resuscitation. 2012; 83:819-822Google Scholar78.Chiu, C.C. ∙ Yen, H.H. ∙ Chen, Y.L. …Severe hyperkalemia with refractory ventricular fibrillation: successful resuscitation using extracorporeal membrane oxygenationAm J Emerg Med. 2014; 32:943.e5-943.e6Google Scholar79.Kao, K.C. ∙ Huang, C.C. ∙ Tsai, Y.H. …Hyperkalemic cardiac arrest successfully reversed by hemodialysis during cardiopulmonary resuscitation: case reportChang Gung Med J. 2000; 23:555-559https://www.ncbi.nlm.nih.gov/pubmed/11092145Google Scholar80.Kose, N. ∙ Bilgin, F.Successful treatment of a patient with cardiac arrest due to hyperkalemia by prolonged cardiopulmonary resuscitation along with hemodialysis: a case report and review of the literatureMedicina (Kaunas). 2021; 57Google Scholar81.Tijssen, J.A. ∙ Filler, G.When CRRT on ECMO is not enough for potassium clearance: a case reportCan J Kidney Health Dis. 2017; 4, 2054358117722559Google Scholar82.Lee, G.T. ∙ Jeong, D. ∙ Park, J.E. …Efficacy of anti-hyperkalemic agents during cardiopulmonary resuscitation in out-of-hospital cardiac arrestHeliyon. 2024; 10, e36345Google Scholar83.Kardalas, E. ∙ Paschou, S.A. ∙ Anagnostis, P. …Hypokalemia: a clinical updateEndocr Connect. 2018; 7:R135-R146Google Scholar84.Tse, G. ∙ Li, K.H.C. ∙ Cheung, C.K.Y. …Arrhythmogenic mechanisms in hypokalaemia: insights from pre-clinical modelsFront Cardiovasc Med. 2021; 8, 620539Google Scholar85.Fan, Y. ∙ Wu, M. ∙ Li, X. …Potassium levels and the risk of all-cause and cardiovascular mortality among patients with cardiovascular diseases: a meta-analysis of cohort studiesNutr J. 2024; 23:8Google Scholar86.Lima, I. ∙ Nunes, J.T. ∙ de Oliveira, I.H. …Association of potassium disorders with the mode of death and etiology in patients with chronic heart failure: the INCOR-HF studySci Rep. 2024; 14:30167Google Scholar87.Hagengaard, L. ∙ Sogaard, P. ∙ Espersen, M. …Association between serum potassium levels and short-term mortality in patients with atrial fibrillation or flutter co-treated with diuretics and rate- or rhythm-controlling drugsEur Heart J Cardiovasc Pharmacother. 2020; 6:137-144Google Scholar88.Ravn Jacobsen, M. ∙ Jabbari, R. ∙ Glinge, C. …Potassium disturbances and risk of ventricular fibrillation among patients with st-segment-elevation myocardial infarctionJ Am Heart Assoc. 2020; 9, e014160Google Scholar89.Huang, B.P. ∙ Zhao, L. ∙ Zhao, X.M. …Serum potassium levels and mortality in hospitalized heart failure patientsRev Cardiovasc Med. 2023; 24:228Google Scholar90.Cohn, J.N. ∙ Kowey, P.R. ∙ Whelton, P.K. …New guidelines for potassium replacement in clinical practice: a contemporary review by the national council on potassium in clinical practiceArch Intern Med. 2000; 160:2429-2436Google Scholar91.Huang, C.L. ∙ Kuo, E.Mechanism of hypokalemia in magnesium deficiencyJ Am Soc Nephrol. 2007; 18:2649-2652Google Scholar92.Epstein, Y. ∙ Yanovich, R.HeatstrokeN Engl J Med. 2019; 380:2449-2459Google Scholar93.Hayashida, K. ∙ Shimizu, K. ∙ Yokota, H.Severe heatwave in JapanAcute Med Surg. 2019; 6:206-207Google Scholar94.Hopkins, P.M. ∙ Girard, T. ∙ Dalay, S. …Malignant hyperthermia 2020: guideline from the association of anaesthetistsAnaesthesia. 2021; 76:655-664Google Scholar95.Rüffert, H. ∙ Bastian, B. ∙ Bendixen, D. …Consensus guidelines on perioperative management of malignant hyperthermia suspected or susceptible patients from the European malignant hyperthermia groupBr J Anaesth. 2021; 126:120-130Google Scholar96.Gong, X.Malignant hyperthermia when dantrolene is not readily availableBMC Anesthesiol. 2021; 21:119Google Scholar97.Cong, Z. ∙ Wan, T. ∙ Wang, J. …Epidemiological and clinical features of malignant hyperthermia: a scoping reviewClin Genet. 2024; 105:233-242Google Scholar98.Eifling, K.P. ∙ Gaudio, F.G. ∙ Dumke, C. …Wilderness medical society clinical practice guidelines for the prevention and treatment of heat illness: 2024 updateWilderness Environ Med. 2024; 35:112s-127sGoogle Scholar99.Lott, C. ∙ Truhlář, A. ∙ Alfonzo, A. …European resuscitation council guidelines 2021: cardiac arrest in special circumstancesResuscitation. 2021; 161:152-219Google Scholar100.Singletary, E.M. ∙ Zideman, D.A. ∙ Bendall, J.C. …2020 international consensus on first aid science with treatment recommendationsResuscitation. 2020; 156:A240-A282Google Scholar101.Zideman, D.A. ∙ Singletary, E.M. ∙ Borra, V. …European resuscitation council guidelines 2021: first aidResuscitation. 2021; 161:270-290Google Scholar102.Roberts, W.O. ∙ Armstrong, L.E. ∙ Sawka, M.N. …ACSM expert consensus statement on exertional heat illness: recognition, management, and return to activityCurr Sports Med Rep. 2023; 22:134-149Google Scholar103.Strapazzon, G. ∙ Procter, E. ∙ Paal, P. …Pre-hospital core temperature measurement in accidental and therapeutic hypothermiaHigh Alt Med Biol. 2014; 15:104-111Google Scholar104.Barletta, J.F. ∙ Palmieri, T.L. ∙ Toomey, S.A. …Society of critical care medicine guidelines for the treatment of heat strokeCrit Care Med. 2025; 53:e490-e500Google Scholar105.Douma, M.J. ∙ Aves, T. ∙ Allan, K.S. …First aid cooling techniques for heat stroke and exertional hyperthermia: a systematic review and meta-analysisResuscitation. 2020; 148:173-190Google Scholar106.Hew-Butler, T. ∙ Rosner, M.H. ∙ Fowkes-Godek, S. …Statement of the 3rd international exercise-associated hyponatremia consensus development conference, Carlsbad, California, 2015Br J Sports Med. 2015; 49:1432-1446Google Scholar107.Bouchama, A. ∙ Dehbi, M. ∙ Chaves-Carballo, E.Cooling and hemodynamic management in heatstroke: practical recommendationsCrit Care. 2007; 11:R54Google Scholar108.Litman, R.S. ∙ Griggs, S.M. ∙ Dowling, J.J. …Malignant hyperthermia susceptibility and related diseasesAnesthesiology. 2018; 128:159-167Google Scholar109.Riazi, S. ∙ Kraeva, N. ∙ Hopkins, P.M.Malignant hyperthermia in the post-genomics era: new perspectives on an old conceptAnesthesiology. 2018; 128:168-180Google Scholar110.Hall, A.P. ∙ Henry, J.A.Acute toxic effects of ‘Ecstasy’ (MDMA) and related compounds: overview of pathophysiology and clinical managementBr J Anaesth. 2006; 96:678-685Google Scholar111.Kollmann-Camaiora, A. ∙ Alsina, E. ∙ Domínguez, A. …Clinical protocol for the management of malignant hyperthermiaRev Esp Anestesiol Reanim. 2017; 64:32-40[In eng spa]Google Scholar112.Centres accredited by the European Malignant Hyperthermia Group.Google Scholar113.Kyotani, Y. ∙ Zhao, J. ∙ Nakahira, K. …The role of antipsychotics and other drugs on the development and progression of neuroleptic malignant syndromeSci Rep. 2023; 13:18459Google Scholar114.Ngo, V. ∙ Guerrero, A. ∙ Lanum, D. …Emergent treatment of neuroleptic malignant syndrome induced by antipsychotic monotherapy using dantroleneClin Pract Cases Emerg Med. 2019; 3:16-23Google Scholar115.Rosenberg, M.R. ∙ Green, M.Neuroleptic malignant syndrome: review of response to therapyArch Int Med. 1989; 149:1927-1931Google Scholar116.Wijdicks, E.F.M. ∙ Ropper, A.H.Neuroleptic malignant syndromeNew England Journal of Medicine. 2024; 391:1130-1138Google Scholar117.Zhang, Y. ∙ Deng, W. ∙ Wang, M. …A real-world pharmacovigilance study of neuroleptic malignant syndrome based on FDA adverse event reporting systemFront Pharmacol. 2024; 15(Original Research) [In English]Google Scholar118.Chiew AL, Isbister GK. Management of serotonin syndrome (toxicity). British Journal of Clinical Pharmacology;n/a(n/a). https://doi.org/10.1111/bcp.16152.Google Scholar119.Gillman, P.K.Serotonin syndrome treated with chlorpromazineJ Clin Psychopharmacol. 1997; 17:128-129Google Scholar120.Mason, P.J. ∙ Morris, V.A. ∙ Balcezak, T.J.Serotonin syndrome. Presentation of 2 cases and review of the literatureMedicine (Baltimore). 2000; 79:201-209Google Scholar121.Morarasu, B.C. ∙ Coman, A.E. ∙ Bologa, C. …Recognition and management of serotonin toxidrome in the emergency department-case based reviewJ Pers Med. 2022; 12Google Scholar122.Nguyen, H. ∙ Pan, A. ∙ Smollin, C. …An 11-year retrospective review of cyproheptadine use in serotonin syndrome cases reported to the California Poison Control SystemJ Clin Pharm Ther. 2019; 44:327-334Google Scholar123.Boehrer, J.D. ∙ Moliterno, D.J. ∙ Willard, J.E. …Influence of labetalol on cocaine-induced coronary vasoconstriction in humansAm J Med. 1993; 94:608-610Google Scholar124.Callaway, C.W. ∙ Clark, R.F.Hyperthermia in psychostimulant overdoseAnn Emerg Med. 1994; 24:68-76Google Scholar125.Castro, A.L. ∙ Tarelho, S. ∙ Almeida, D. …MDMA intoxication in a potential organ donor with cardiac arrestJ Anal Toxicol. 2020; 44:923-926Google Scholar126.Chen, J.P.Methamphetamine-associated acute myocardial infarction and cardiogenic shock with normal coronary arteries: refractory global coronary microvascular spasmJ Invasive Cardiol. 2007; 19:E89-E92Google Scholar127.Grunau, B.E. ∙ Wiens, M.O. ∙ Brubacher, J.R.Dantrolene in the treatment of MDMA-related hyperpyrexia: a systematic reviewCjem. 2010; 12:435-442Google Scholar128.Hollander, J.E. ∙ Carter, W.A. ∙ Hoffman, R.S.Use of phentolamine for cocaine-induced myocardial ischemiaN Engl J Med. 1992; 327:361Google Scholar129.Hysek, C. ∙ Schmid, Y. ∙ Rickli, A. …Carvedilol inhibits the cardiostimulant and thermogenic effects of MDMA in humansBr J Pharmacol. 2012; 166:2277-2288Google Scholar130.Kiyatkin, E.A. ∙ Ren, S.Clubbing with ecstasyTemperature (Austin). 2014; 1:160-161Google Scholar131.Lavonas, E.J. ∙ Akpunonu, P.D. ∙ Arens, A.M. …2023 American heart association focused update on the management of patients with cardiac arrest or life-threatening toxicity due to poisoning: an update to the american heart association guidelines for cardiopulmonary resuscitation and emergency cardiovascular careCirculation. 2023; 148:e149-e184Google Scholar132.Liechti, M.E. ∙ Kunz, I. ∙ Kupferschmidt, H.Acute medical problems due to Ecstasy use. Case-series of emergency department visitsSwiss Med Wkly. 2005; 135:652-657Google Scholar133.Lucyk, S.N.Acute cardiovascular toxicity of cocaineCanadian J Cardiol. 2022; 38:1384-1394Google Scholar134.Matsumoto, R.R. ∙ Seminerio, M.J. ∙ Turner, R.C. …Methamphetamine-induced toxicity: an updated review on issues related to hyperthermiaPharmacol Ther. 2014; 144:28-40Google Scholar135.Mende, L. ∙ Böhm, R. ∙ Regenthal, R. …Cardiac arrest caused by an ecstasy intoxicationAnasthesiol Intensivmed Notfallmed Schmerzther. 2005; 40:762-765[In ger]Google Scholar136.Mueller, P.D. ∙ Korey, W.S.Death by “ecstasy”: the serotonin syndrome?Ann Emerg Med. 1998; 32:377-380Google Scholar137.Yap, C.Y.L. ∙ Taylor, D.M. ∙ Knott, J.C. …Intravenous midazolam-droperidol combination, droperidol or olanzapine monotherapy for methamphetamine-related acute agitation: subgroup analysis of a randomized controlled trialAddiction. 2017; 112:1262-1269Google Scholar138.Burns, M.J. ∙ Linden, C.H. ∙ Graudins, A. …A comparison of physostigmine and benzodiazepines for the treatment of anticholinergic poisoningAnnals of Emergency Medicine. 2000; 35:374-381Google Scholar139.Dawson, A.H. ∙ Buckley, N.A.Pharmacological management of anticholinergic delirium – theory, evidence and practiceBr J Clin Pharmacol. 2016; 81:516-524Google Scholar140.Green, R. ∙ Sitar, D.S. ∙ Tenenbein, M.Effect of anticholinergic drugs on the efficacy of activated charcoalJ Toxicol Clin Toxicol. 2004; 42:267-272Google Scholar141.Jamshidi, N. ∙ Dawson, A.The hot patient: acute drug-induced hyperthermiaAust Prescr. 2019; 42:24-28Google Scholar142.Rasimas, J.J. ∙ Sachdeva, K.K. ∙ Donovan, J.W.Revival of an antidote: bedside experience with physostigmineToxicology Communications. 2018; 2:85-101Google Scholar143.Haller, C.A. ∙ Benowitz, N.L.Adverse cardiovascular and central nervous system events associated with dietary supplements containing ephedra alkaloidsNew England Journal of Medicine. 2000; 343:1833-1838Google Scholar144.Pentel, P.Toxicity of over-the-counter stimulantsJAMA. 1984; 252:1898-1903Google Scholar145.Rhidian, R.Running a risk? Sport supplement toxicity with ephedrine in an amateur marathon runner, with subsequent rhabdomyolysisBMJ Case Rep. 2011; 2011Google Scholar146.Chyka, P.A. ∙ Erdman, A.R. ∙ Christianson, G. …Salicylate poisoning: An evidence-based consensus guideline for out-of-hospital managementClin Toxicol. 2007; 45:95-131Google Scholar147.Juurlink, D.N. ∙ Gosselin, S. ∙ Kielstein, J.T. …Extracorporeal treatment for salicylate poisoning: systematic review and recommendations from the EXTRIP workgroupAnnals of Emergency Medicine. 2015; 66:165-181Google Scholar148.Grundlingh, J. ∙ Dargan, P.I. ∙ El-Zanfaly, M. …2,4-dinitrophenol (DNP): a weight loss agent with significant acute toxicity and risk of deathJ Med Toxicol. 2011; 7:205-212Google Scholar149.Kopec, K.T. ∙ Kim, T. ∙ Mowry, J. …Role of dantrolene in dinitrophenol (DNP) overdose: a continuing question?Am J Emerg Med. 2019; 37:1216.e1-1216.e2Google Scholar150.Pasquier, M. ∙ Cools, E. ∙ Zafren, K. …Vital signs in accidental hypothermiaHigh Alt Med Biol. 2021; 22:142-147Google Scholar151.Frei, C. ∙ Darocha, T. ∙ Debaty, G. …Clinical characteristics and outcomes of witnessed hypothermic cardiac arrest: a systematic review on rescue collapseResuscitation. 2019; 137:41-48Google Scholar152.Podsiadlo, P. ∙ Darocha, T. ∙ Svendsen, O.S. …Outcomes of patients suffering unwitnessed hypothermic cardiac arrest rewarmed with extracorporeal life support: a systematic reviewArtif Organs. 2021; 45:222-229Google Scholar153.Mydske, S. ∙ Thomassen, O.Is prehospital use of active external warming dangerous for patients with accidental hypothermia: a systematic reviewScand J Trauma Resusc Emerg Med. 2020; 28:77Google Scholar154.Fujimoto, Y. ∙ Matsuyama, T. ∙ Morita, S. …Indoor versus outdoor occurrence in mortality of accidental hypothermia in japan: the j-point registryTher Hypothermia Temp Manag. 2020; 10:159-164Google Scholar155.Mroczek, T. ∙ Gladki, M. ∙ Skalski, J.Successful resuscitation from accidental hypothermia of 11.8 degrees C: where is the lower bound for human beings?Eur J Cardiothorac Surg. 2020; 58:1091-1092Google Scholar156.Musi, M.E. ∙ Sheets, A. ∙ Zafren, K. …Clinical staging of accidental hypothermia: the revised swiss system: recommendation of the international commission for mountain emergency medicine (ICAR MedCom)Resuscitation. 2021; 162:182-187Google Scholar157.Paal, P. ∙ Pasquier, M. ∙ Darocha, T. …Accidental Hypothermia: 2021 UpdateInt J Environ Res Public Health. 2022; 19Google Scholar158.Pasquier, M. ∙ Hugli, O. ∙ Paal, P. …Hypothermia outcome prediction after extracorporeal life support for hypothermic cardiac arrest patients: the HOPE scoreResuscitation. 2018; 126:58-64Google Scholar159.Pasquier, M. ∙ Paal, P. ∙ Kosinski, S. …Esophageal temperature measurementN Engl J Med. 2020; 383:e93Google Scholar160.Pasquier, M. ∙ Rousson, V. ∙ Darocha, T. …Hypothermia outcome prediction after extracorporeal life support for hypothermic cardiac arrest patients: an external validation of the HOPE scoreResuscitation. 2019; 139:321-328Google Scholar161.Podsiadlo, P. ∙ Brozek, T. ∙ Balik, M. …Predictors of cardiac arrest in severe accidental hypothermiaAm J Emerg Med. 2024; 78:145-150Google Scholar162.Woodhall, B. ∙ Sealy, W.C. ∙ Hall, K.D. …Craniotomy under conditions of quinidine-protected cardioplegia and profound hypothermiaAnn Surg. 1960; 152:37-44Google Scholar163.Pasquier, M. ∙ Zurron, N. ∙ Weith, B. …Deep accidental hypothermia with core temperature below 24 degrees c presenting with vital signsHigh Alt Med Biol. 2014; 15:58-63Google Scholar164.Soar J, Bottiger BW, Carli P, et al. European Resuscitation Council Guidelines 2025: Adult Advanced Life Support. 2025;215 (Suppl 1):110769.Google Scholar165.Pasquier M ea. Estimation of the survival probability using HOPE. (https://www.hypothermiascore.org).Google Scholar166.Gordon, L. ∙ Paal, P.Normothermic and hypothermic cardiac arrest-Beware of Jekyll and HydeResuscitation. 2018; 129:e10-e11Google Scholar167.Wood, S.C.Interactions between hypoxia and hypothermiaAnnu Rev Physiol. 1991; 53:71-85Google Scholar168.Mair, P. ∙ Gasteiger, L. ∙ Mair, B. …Successful defibrillation of four hypothermic patients with witnessed cardiac arrestHigh Alt Med Biol. 2019; 20:71-77Google Scholar169.Stoner, J. ∙ Martin, G. ∙ O’Mara, K. …Amiodarone and bretylium in the treatment of hypothermic ventricular fibrillation in a canine modelAcad Emerg Med. 2003; 10:187-191Google Scholar170.Krismer, A.C. ∙ Lindner, K.H. ∙ Kornberger, R. …Cardiopulmonary resuscitation during severe hypothermia in pigs: does epinephrine or vasopressin increase coronary perfusion pressure?Anesth Analg. 2000; 90:69-73Google Scholar171.Kornberger, E. ∙ Lindner, K.H. ∙ Mayr, V.D. …Effects of epinephrine in a pig model of hypothermic cardiac arrest and closed-chest cardiopulmonary resuscitation combined with active rewarmingResuscitation. 2001; 50:301-308Google Scholar172.Cools, E. ∙ Meyer, M. ∙ Courvoisier, D. …Successful pre-rewarming resuscitation after cardiac arrest in severe hypothermia: a retrospective cohort study from the international hypothermia registryInt J Environ Res Public Health. 2022; 19Google Scholar173.Gordon, L. ∙ Paal, P. ∙ Ellerton, J.A. …Delayed and intermittent CPR for severe accidental hypothermiaResuscitation. 2015; 90:46-49Google Scholar174.Takauji, S. ∙ Hayakawa, M. ∙ Yamada, D. …Outcome of extracorporeal membrane oxygenation use in severe accidental hypothermia with cardiac arrest and circulatory instability: a multicentre, prospective, observational study in Japan (ICE-CRASH study)Resuscitation. 2023; 182, 109663Google Scholar175.Ruttmann, E. ∙ Weissenbacher, A. ∙ Ulmer, H. …Prolonged extracorporeal membrane oxygenation-assisted support provides improved survival in hypothermic patients with cardiocirculatory arrestJ Thorac Cardiovasc Surg. 2007; 134:594-600Google Scholar176.Mendrala, K. ∙ Darocha, T. ∙ Pluta, M. …Outcomes of extracorporeal life support in hypothermic cardiac arrest: revisiting ELSO guidelinesResuscitation. 2024; 205, 110424Google Scholar177.Gruber, E. ∙ Beikircher, W. ∙ Pizzinini, R. …Non-extracorporeal rewarming at a rate of 6.8 degrees C per hour in a deeply hypothermic arrested patientResuscitation. 2014; 85:e119-e120Google Scholar178.Kuhnke, M. ∙ Albrecht, R. ∙ Schefold, J.C. …Successful resuscitation from prolonged hypothermic cardiac arrest without extracorporeal life support: a case reportJ Med Case Rep. 2019; 13:354Google Scholar179.Okada, Y. ∙ Matsuyama, T. ∙ Morita, S. …The development and validation of a “5A” severity scale for predicting in-hospital mortality after accidental hypothermia from J-point registry dataJ Intensive Care. 2019; 7:27Google Scholar180.Okada, Y. ∙ Matsuyama, T. ∙ Hayashida, K. …External validation of 5A score model for predicting in-hospital mortality among the accidental hypothermia patients: JAAM-hypothermia study 2018-2019 secondary analysisJ Intensive Care. 2022; 10:24Google Scholar181.Swol, J. ∙ Darocha, T. ∙ Paal, P. …Extracorporeal life support in accidental hypothermia with cardiac arrest-a narrative reviewASAIO J. 2022; 68:153-162Google Scholar182.Rauch, S. ∙ Brugger, H. ∙ Falk, M. …Avalanche survival rates in Switzerland, 1981-2020JAMA Netw Open. 2024; 7, e2435253Google Scholar183.Boue, Y. ∙ Payen, J.F. ∙ Brun, J. …Survival after avalanche-induced cardiac arrestResuscitation. 2014; 85:1192-1196Google Scholar184.Moroder, L. ∙ Mair, B. ∙ Brugger, H. …Outcome of avalanche victims with out-of-hospital cardiac arrestResuscitation. 2015; 89:114-118Google Scholar185.Metrailler-Mermoud, J. ∙ Hugli, O. ∙ Carron, P.N. …Avalanche victims in cardiac arrest are unlikely to survive despite adherence to medical guidelinesResuscitation. 2019; 141:35-43Google Scholar186.Procter, E. ∙ Strapazzon, G. ∙ Dal Cappello, T. …Burial duration, depth and air pocket explain avalanche survival patterns in Austria and SwitzerlandResuscitation. 2016; 105:173-176Google Scholar187.Rauch, S. ∙ Koppenberg, J. ∙ Josi, D. …Avalanche survival depends on the time of day of the accident: a retrospective observational studyResuscitation. 2022; 174:47-52Google Scholar188.Pasquier, M. ∙ Strapazzon, G. ∙ Kottmann, A. …On-site treatment of avalanche victims: scoping review and 2023 recommendations of the international commission for mountain emergency medicine (ICAR MedCom)Resuscitation. 2023; 184, 109708Google Scholar189.Genswein, M. ∙ Macias, D. ∙ McIntosh, S. …AvaLife-A new multi-disciplinary approach supported by accident and field test data to optimize survival chances in rescue and first aid of avalanche patientsInt J Environ Res Public Health. 2022; 19Google Scholar190.Egger, A. ∙ Niederer, M. ∙ Tscherny, K. …Influence of physical strain at high altitude on the quality of cardiopulmonary resuscitationScand J Trauma Resusc Emerg Med. 2020; 28:19Google Scholar191.Putzer, G. ∙ Braun, P. ∙ Zimmermann, A. …LUCAS compared to manual cardiopulmonary resuscitation is more effective during helicopter rescue-a prospective, randomized, cross-over manikin studyAm J Emerg Med. 2013; 31:384-389Google Scholar192.Gassler, H. ∙ Kurka, L. ∙ Rauch, S. …Mechanical chest compression devices under special circumstancesResuscitation. 2022; 179:183-188Google Scholar193.Konstantinides, S.V. ∙ Meyer, G. ∙ Becattini, C. …2019 ESC Guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS)Eur Heart J. 2020; 41:543-603Google Scholar194.Javaudin, F. ∙ Lascarrou, J.B. ∙ Le Bastard, Q. …Thrombolysis during resuscitation for out-of-hospital cardiac arrest caused by pulmonary embolism increases 30-day survival: findings from the French national cardiac arrest registryChest. 2019; 156:1167-1175Google Scholar195.Bottiger, B.W. ∙ Arntz, H.R. ∙ Chamberlain, D.A. …Thrombolysis during resuscitation for out-of-hospital cardiac arrestN Engl J Med. 2008; 359:2651-2662Google Scholar196.Bergum, D. ∙ Nordseth, T. ∙ Mjolstad, O.C. …Causes of in-hospital cardiac arrest – incidences and rate of recognitionResuscitation. 2015; 87:63-68Google Scholar197.Kurkciyan, I. ∙ Meron, G. ∙ Sterz, F. …Pulmonary embolism as a cause of cardiac arrest: presentation and outcomeArch Intern Med. 2000; 160:1529-1535Google Scholar198.Pudil, J. ∙ Rob, D. ∙ Smalcova, J. …Pulmonary embolism-related refractory out-of-hospital cardiac arrest and extracorporeal cardiopulmonary resuscitation: prague OHCA study post hoc analysisEur Heart J Acute Cardiovasc Care. 2023; 12:507-512Google Scholar